إعادة ترتيب هوفمان
إعادة ترتيب هوفمان هو تفاعل عضوي يتحول فيه أميد أولي إلى أمين أولي، ويترافق ذلك بفقدان ذرة كربون من السلسلة الكربونية.[1][2][3]
يحدث هذا التفاعل بوجود حفاز من البروم وهيدروكسيد الصوديوم. ويتضمن أكسدة النتروجين ثم حدوث تفاعل إعادة ترتيب للكربونيل والنتروجين إلى مركب وسطي من الإيزوسيانات.
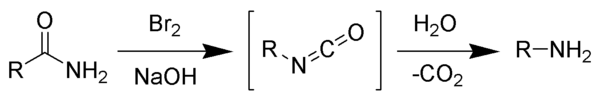
ينسب التفاعل إلى مكتشفه الكيميائي الألماني آوغست فيلهلم فون هوفمان، ولا ينبغي الخلط بينه وبين تفاعل حذف هوفمان، وهو تفاعل اسمي آخر.
الآلية
يؤدي تفاعل البروم مع هيدروكسيد الصوديوم إلى تشكل هيبوبروميت الصوديوم في الموقع، والذي يساهم في حدوث تفاعل أكسدة واختزال مما يؤدي إلى الحصول على مركب وسطي من الإيزوسيانات، ولا يتشكل مركب وسطي من النترين، لأن تشكل الأخير سيؤدي في النهاية إلى تشكل حمض الهيدروكساميك على هيئة منتج ثانوي، وهو أمر لم يثبت حدوثه. يتحلمه مركب الإيزوسيانات الوسطي إلى أمين أولي مع انطلاق ثنائي أكسيد الكربون.[2]
تحويرات
استخدمت عدد من الكواشف الكيميائية بديلة عن البروم، مثل هيبوكلوريت الصوديوم،[4] وأسيتات الرصاص الرباعي،[5]
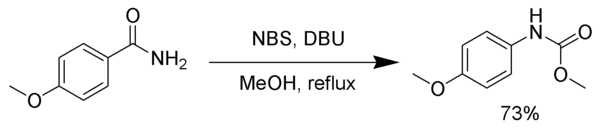
يمكن احتجاز مركب الإيزوسيانات الوسطي باستخدام عدد من محبات النوى (نكليوفيلات) من أجل تشكيل الكربامات أو مركبات أخرى بدلاً من الخضوع لتفاعل نزع كربوكسيل. في المثال التالي يستخدم وسط من N-بروموسكسينيميد والميثانول لإجراء تفاعل إعادة ترتيب هوفمان محوّر.[6]
الاستخدامات
يستخدم هذا التفاعل في تحضير حمض الأنثرانيليك والفثاليميد؛[7] ويتحول وفقه النيكوتيناميد إلى 3-أمينو البيريدين.[8]
طالع أيضاً
المراجع
- ^ Hofmann، A. W. (1881). "Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide" [On the action of bromine in alkaline solution on amides]. Berichte der Deutschen Chemischen Gesellschaft. ج. 14 ع. 2: 2725–2736. DOI:10.1002/cber.188101402242. مؤرشف من الأصل في 2022-11-22.
- ^ ا ب Everett، Wallis؛ Lane، John (1946). The Hofmann Reaction. ج. 3. ص. 267–306. DOI:10.1002/0471264180.or003.07. ISBN:9780471005285.
{استشهاد بكتاب}:|صحيفة=تُجوهل (مساعدة) - ^ Shioiri، Takayuki (1991). "Degradation Reactions". Comprehensive Organic Synthesis. ج. 6. ص. 795–828. DOI:10.1016/B978-0-08-052349-1.00172-4. ISBN:9780080359298.
- ^ Mohan، Ram S.؛ Monk، Keith A. (1999). "The Hofmann Rearrangement Using Household Bleach: Synthesis of 3-Nitroaniline". Journal of Chemical Education. ج. 76 ع. 12: 1717. Bibcode:1999JChEd..76.1717M. DOI:10.1021/ed076p1717. مؤرشف من الأصل في 2024-08-09.
- ^ Baumgarten, Henry؛ Smith, Howard؛ Staklis, Andris (1975). "Reactions of amines. XVIII. Oxidative rearrangement of amides with lead tetraacetate". The Journal of Organic Chemistry. ج. 40 ع. 24: 3554–3561. DOI:10.1021/jo00912a019.
- ^ Keillor، Jeffrey W.؛ Huang، Xicai (2002). "Methyl Carbamate Formation via Modified Hofmann Rearrangement Reactions: Methyl N-(p-Methoxyphenyl)carbamate". Organic Syntheses. ج. 78: 234. DOI:10.15227/orgsyn.078.0234.
- ^ Maki، Takao؛ Takeda، Kazuo (2000). "Benzoic Acid and Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. DOI:10.1002/14356007.a03_555. ISBN:3527306730..
- ^ (1950)"3-Aminopyridine". Org. Synth.30: 3; Coll. Vol. 4: 45. DOI:10.15227/orgsyn.030.0003.
