فينيل أسيتالدهيد
| فينيل أسيتالدهيد | |
|---|---|
| المعرفات | |
| رقم التسجيل (CAS) | |
| CAS | 122-78-1 |
| بوب كيم | 998[1] |
|
|
| الخواص | |
| الصيغة الجزيئية | C8H8O |
| الكتلة المولية | 120.15 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.08 غ/سم3 |
| نقطة الانصهار | −10 °س |
| نقطة الغليان | 195 °س |
| الذوبانية في الماء | 2.21 غ/ل ماء |
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | خطر |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
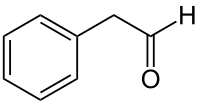
فينيل أسيتالدهيد (أو فينيل إيثانال) هو مركب عضوي صيغته الكيميائية C8H8O ويوجد على هيئة سائل عديم اللون.
يصنف المركب كيميائياً ضمن الألدهيدات؛ وهو من المنتجات الطبيعية.
الوفرة الطبيعية

يوجد فينيل أسيتالدهيد طبيعياً في عدد من النباتات، لأنه يصطنع حيوياً من الحمض الأميني الشائع فينيل ألانين. يتوفر هذا المركب القرفة الحقيقية والحنطة السوداء والفاصولياء الشائعة.[3] يوجد هذا المركب أيضاً في الشوكولاتة.[4] بالإضافة إلى ذلك فإن هذا المركب متواجد في توت العليق والتفاح والبطاطا والبطيخ والدراق والتمر الهندي والطماطم. كما يعد هذا المركب ذو الرائحة مكوناً في رائحة عدد من الأزهار والفيرومونات لعدد من الحشرات.[5]
التحضير
يحضر هذا المركب من تفاعل مصاوغة محفز حمضياً من أكسيد الستايرين؛[6] أو من إعادة ترتيب هوفمان لمركب سيناماميد؛[7][8] أو من أكسدة حلقي الأوكتاتترايين بمحلول مائي من كبريتات الزئبق الثنائي؛[9][10] أو من تحلل شتريكر للفينيل ألانين.[11]
الخواص
يتبلمر هذا المركب بسبب النشاط الكيميائي الكبير إلى سائل لزج، وله رائحة عطرة تشبه رائحة الرحيق أو العسل.
الاستخدامات
يستخدم هذا المركب في تحضير العطور.[12]
طالع أيضاً
المراجع
- ^ ا ب ج د phenylacetaldehyde (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Janes D، Kantar D، Kreft S، Prosen H (2009). "Identification of buckwheat (Fagopyrum esculentum Moench) aroma compounds with GC-MS". Food Chemistry. ج. 112 ع. 1: 120–124. DOI:10.1016/j.foodchem.2008.05.048.
- ^ P. Schnermann, P. Schieberle: Evaluation of key odorants in milk chocolate and cocoa cass by aroma extract dilution analyses, in: J. Agric. Food Chem., 45, 1997, S. 867–872.
- ^ El-Sayed، Ashraf. "Semiochemical-2-phenylacetaldehyde". The Pherobase: Database of Insect Pheromones and Semiochemicals. Extensive Database of Insect Pheromones and Semiochemicals. مؤرشف من الأصل في 2017-06-30. اطلع عليه بتاريخ 2014-11-26.
- ^ I. Salla; O. Bergada; P. Salagre; Y. Cesteros; F. Medina; J. E. Sueiras; T. Montanari: Isomerisation of styrene oxide to phenylacetaldehyde by fluorinated mordenites using microwaves, in: Journal of Catalysis, 232, 2005, S. 239–245; doi:10.1016/j.jcat.2004.10.011.
- ^ Weerman، R.A. (1913). "Einwirkung von Natriumhypochlorit auf Amide ungesättigter Säuren". Justus Liebigs Annalen der Chemie. ج. 401 ع. 1: 1–20. DOI:10.1002/jlac.19134010102. مؤرشف من الأصل في 2023-02-08.
- ^ Adams، Rodger (1946). Organic Reactions Volume III. New York: John Wiley and Sons Inc. ص. 275, 276, & 285. ISBN:9780471005285.
- ^ Reppe، Walter؛ Schlichting، Otto؛ Klager، Karl؛ Toepel، Tim (1948). "Cyclisierende Polymerisation von Acetylen I Über Cyclooctatetraen". Justus Liebigs Annalen der Chemie. ج. 560 ع. 1: 1–92. DOI:10.1002/jlac.19485600102.
- ^ Kunichika، Sango (1953). "Cyclopolyolefins Derived from Acetylene". Bulletin of the Institute for Chemical Research, Kyoto University. ج. 31 ع. 5: 323–335. hdl:2433/75368.
- ^ Schonberg، Alexander؛ Radwan، Moubacher (1952). "The Strecker Degradation of α-Amino Acids". Chemical Reviews. ج. 52 ع. 2: 261–277. DOI:10.1021/cr60156a002.
- ^ Kohlpaintner، Christian؛ Schulte، Markus؛ Jürgen، Falbe؛ Lappe، Peter؛ Jürgen، Weber؛ Frey، Guido (2014). "Aldehydes, Araliphatic". Ullmann's Encyclopedia of Industrial Chemistry. ج. 1. DOI:10.1002/14356007.m01_m03.pub2. ISBN:9783527334773.