2,5-dimethylfuran
| 2,5-dimethylfuran | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,5-dimethylfuran |
| Sumární vzorec | C6H8O |
| Vzhled | žlutá olejovitá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 625-86-5 |
| EC-no (EINECS/ELINCS/NLP) | 210-914-3 |
| PubChem | 12266 |
| ChEBI | 89052 |
| SMILES | CC1=CC=C(O1)C |
| InChI | InChI=1S/C6H8O/c1-5-3-4-6(2)7-5/h3-4H,1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 96,127 g/mol |
| Teplota tání | −62,8 °C (210,4 K)[1] |
| Teplota varu | 93,5 °C (366,6 K)[1] |
| Hustota | 2,1683 g/cm3[1] |
| Rozpustnost ve vodě | málo rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Tlak páry | 7,0 kPa (22 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H302 H315 H317 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P264+265 P270 P271 P272 P280 P301+317 P302+352 P303+361+353 P304+340 P305+351+338 P319 P321 P330 P332+317 P333+313 P337+317 P362+364 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | −1 °C (272 K)[1] |
| Teplota vznícení | 286 °C (559 K)[2] |
Některá data mohou pocházet z datové položky. | |
2,5-dimethylfuran je heterocyklická organická sloučenina se vzorcem (CH3)2C4H2O. Má možné využití jako biopalivo, získatelné z celulózy.
Výroba
Fruktózu lze katalyticky přeměnit na 2,5-dimethylfuran; meziproduktem je přitom hydroxymethylfurfural.[3][4]
Fruktóza se dá získat z glukózy, vznikající rozkladem celulózy.[5][6]
Využití jako biopalivo
2,5-dimethylfuran má řadu vlastností, díky kterým je použitelný jako biopalivo. Jeho hustota energie je o 40 % vyšší než u ethanolu a podobná, jakou má benzin. Látka je také chemicky stálá a nerozpustná ve vodě, neabsorbuje tak vzdušnou vlhkost. Odpařování dimethylfuranu vyžaduje oproti ethanolu přibližně o třetinu méně energie,[3][7] přestože je jeho teplota varu, 92 °C, o 14 °C vyšší než u ethanolu (78 °C).
Možnost rychlé výroby dimethylfuranu z fruktózy, získatelné z ovoce a některých druhů zeleniny, nebo glukózy, kterou lze vyrobit ze škrobu a celulózy, snadno dostupných z přírodních zdrojů – zvyšuje zájem o dimethylfuran. Nejčastějšími biopalivy jsou však bioethanol a bionafta.
Stechiometrický poměr vzduch/palivo činí u dimethylfuranu 10,72, zatímco u ethanolu 8,95 a u benzinu 14,56.[2] Ke spálení dimethylfuranu tak stačí o asi 33 % méně vzduchu než u benzinu, ovšem přibližně o 20 % více, než u stejného množství ethanolu.
Spalné teplo kapalného dimethylfuranu je 33,7 MJ/kg, u ethanolu 26,9 MJ/kg a u benzinu 43,2 MJ/kg.[2] Oktanové číslo má hodnotu 119.[2] Měrné skupenské teplo varu činí 31,91 kJ/mol při 20 °C.[2] Tepelná účinnost spalování dimethylfuranu se podobá benzinu.[8]
Ostatní použití
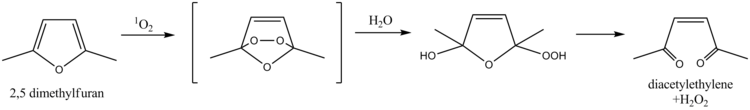
2,5-dimethylfuran se dá použít k zachytávání singletového kyslíku a jeho stanovení ve vodě. Mechanismus spočívá v Dielsově–Alderově reakci a hydrolýze, které vedou ke vzniku diacetylethylenu a peroxidu vodíku. Ke stejnému účelu může sloužit i furfurylalkohol.[9]
2,5-dimethylfuran byl také navržen jako interní standard v NMR spektroskopii. 2,5-dimethylfuran má singlety v 1H NMR spektru na δ 2,2 a 5,8. Teplota varu 92 °C omezuje ztráty vypařováním i snadné odstranění.[10]
V chemii potravin
2,5-dimethylfuran se vytváří tepelným rozkladem některých sacharidů a byl ve stopových množstvích nalezen v karamelizovaných cukrech.[11]
Toxikologie
2,5-dimethylfuran je součástí mechanismu neurotoxicity hexanu u lidí, jehož je, společně s hexan-2,5-dionem a 4,5-dihydroxy-hexan-2-onem, jedním z hlavních metabolitů.[12]
2,5-dimethylfuran se také nachází v cigaretovém kouři, kde poškozuje řasinky v dýchacím ústrojí, které mají odstraňovat cizorodé částice.[13] Jeho koncentraci v krvi je možné využít jako biomarker kouření.[14]
Srovnání bezpečnostních listů ukazuje,[15][16][17] že nakládání s 2,5-dimethylfuranem je srovnatelně nebezpečné jako v případě benzinu.[18][19][20]
Reference
V tomto článku byl použit překlad textu z článku 2,5-Dimethylfuran na anglické Wikipedii.
- ↑ a b c d e f g h i j k https://pubchem.ncbi.nlm.nih.gov/compound/12266
- ↑ a b c d e Direct-Injection Engine Study Finds That DMF Is a Promising Biofuel, With Combustion Performance and Regulated Emissions Comparable to Gasoline | Eco Friendly [online]. Dostupné v archivu pořízeném z originálu dne 2013-01-21.
- ↑ a b Yuriy Román-Leshkov; Christopher J. Barrett; Zhen Y. Liu; James A. Dumesic. Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates. Nature. 2007, s. 982–985. DOI 10.1038/nature05923. PMID 17581580.
- ↑ Matt McGrath. Fruit could make 'powerful fuel' [online]. BBC News, 2007-06-21 [cit. 2007-06-22]. Dostupné v archivu pořízeném z originálu dne 2007-08-17.
- ↑ Haibo Zhao; Johnathan E. Holladay; Heather Brown; Z. Conrad Zhang. Metal Chlorides in Ionic Liquid Solvents Convert Sugars to 5-Hydroxymethylfurfural. Science. 2007-06-15, s. 1597–1600. DOI 10.1126/science.1141199. PMID 17569858.
- ↑ Plastic that grows on trees [online]. Pacific Northwest National Laboratory, 2007-06-21 [cit. 2007-06-22]. Dostupné v archivu pořízeném z originálu dne 2007-07-13.
- ↑ James Beal. Engineers develop higher-energy liquid-transportation fuel from sugar [online]. University of Wisconsin-Madison, 2007-06-20 [cit. 2007-06-22]. Dostupné v archivu pořízeném z originálu dne 2007-07-01.
- ↑ Green Car Congress: Direct-Injection Engine Study Finds That DMF Is a Promising Biofuel, With Combustion Performance and Regulated Emissions Comparable to Gasoline [online]. [cit. 2011-03-17]. Dostupné v archivu pořízeném z originálu dne 2011-12-24.
- ↑ Patrick L. Brezonik. Chemical Kinetics and Process Dynamics in Aquatic Systems. CRC Press, 1994, p. 671. [1] Archivováno 24. 7. 2020 na Wayback Machine.
- ↑ S. W. Gerritz; A. M. Sefler. 2,5-Dimethylfuran (DMFu): An Internal Standard for the "Traceless" Quantitation of Unknown Samples via 1H NMR. ACS Combinatorial Science. 2000, s. 39–41. DOI 10.1021/cc990041v. PMID 10813883.
- ↑ W. D. Powrie; C. H. Wu; V. P. Molund. Browning reaction systems as sources of mutagens and antimutagens. Environmental Health Perspectives. 1986, s. 47–54. DOI 10.2307/3430317. PMID 3757959.
- ↑ Peter Arlien-Søborg. Solvent Neurotoxicity. CRC Press, 1992. ISBN 0-8493-6234-2. [2] Archivováno 21. 2. 2021 na Wayback Machine.
- ↑ Donald Shopland. Cigars: Health Effects and Trends. DIANE Publishing, 1998. [3] Archivováno 24. 7. 2020 na Wayback Machine.
- ↑ ASHLEY, D. L.; BONIN, M. A.; HAMAR, B.; MCGEEHIN, M. Using the blood concentration of 2,5-dimethylfuran as a marker for smoking. International Archives of Occupational and Environmental Health. 1996, s. 183–7. Dostupné v archivu pořízeném z originálu dne 2021-02-21. DOI 10.1007/BF00381629. PMID 8919847. S2CID 22233967.
- ↑ Safety Data Sheet: 2,5-Dimethylfuran [online]. [cit. 2014-03-07]. Dostupné v archivu pořízeném z originálu dne 2014-03-07.
- ↑ 2,5-Dimethylfuran(625-86-5) [online]. [cit. 2017-07-21]. Dostupné v archivu pořízeném z originálu dne 2017-05-04.
- ↑ Material Safety Data Sheet: 2,5-Dimethylfuran [online]. Dostupné online.[nedostupný zdroj]
- ↑ Equiva Services - MSDS [online]. Dostupné v archivu pořízeném z originálu dne 2011-07-10.
- ↑ hazard.com [online]. [cit. 2010-12-27]. Dostupné v archivu pořízeném z originálu dne 2011-07-11.
- ↑ hazard.com [online]. [cit. 2010-12-27]. Dostupné v archivu pořízeném z originálu dne 2011-07-11.
Externí odkazy
 Obrázky, zvuky či videa k tématu 2,5-dimethylfuran na Wikimedia Commons
Obrázky, zvuky či videa k tématu 2,5-dimethylfuran na Wikimedia Commons