Bergamoteno
| Bergamoteno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| (E)-4-[(3,7-Dimethyl-2,6-octadienyl)oxy]- 7H-furo[3,2-g][1]benzopyran-7-one | ||
| General | ||
| Otros nombres |
Bergamotine 5-Geranoxypsoralen | |
| Fórmula estructural |
 | |
| Fórmula molecular | C21H22O4 | |
| Identificadores | ||
| Número CAS | 7380-40-7[1] | |
| ChEBI | 70476 | |
| ChEMBL | 1078442 | |
| ChemSpider | 4581520 | |
| PubChem | 5471349 | |
| UNII | JMU611YFRB | |
|
CC(=CCC/C(=C/COC1=C2C=CC(=O)OC2=CC3=C1C=CO3)/C)C
| ||
| Propiedades físicas | ||
| Masa molar | 338,397 g/mol | |
| Punto de fusión | 55 °C (328 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El bergamoteno, también conocido como bergamotina, es una furanocumarina natural que se encuentra principalmente en el zumo de pomelo. También se encuentra en el aceite de bergamota, desde el que fue aislado por primera vez y de la que se deriva su nombre. En menor medida, la bergamotina también está presente en los aceites esenciales de otros cítricos. Junto con el compuesto químicamente relacionado 6 ', 7'-dihidroxibergamotina, se cree que es responsable para el efecto del zumo de pomelo (toronja), en el que el consumo del zumo afecta el metabolismo de una variedad de fármacos farmacéuticos.[2]
Química
En términos químicos, bergamotina y dihidroxibergamotina son furanocoumarinas lineales funcionalizadas con cadenas laterales derivadas de geraniol. Son inhibidores de algunas isoformas del citocromo P450, en particular la enzima CYP3A4. Esto evita el metabolismo oxidativo de ciertos fármacos por la enzima, lo que resulta en una elevada concentración de fármaco en el torrente sanguíneo.
Bajo circunstancias normales, el efecto del zumo de pomelo se considera que es una interacción negativa, y los pacientes a menudo se les advierte que no consuman toronja o su jugo al tomar la medicación. Sin embargo, algunas investigaciones en curso se centran en los beneficios potenciales de la inhibición del citocromo P450.[3] Bergamotina, dihidroxibergamotina, o análogos sintéticos puede ser desarrollado como fármacos que se dirigen a aumentar la oral, la biodisponibilidad de otros fármacos. Los medicamentos que pueden tener un uso limitado debido a que son metabolizados por CYP3A4 y puede convertirse en medicamentos viables cuando se toma con un inhibidor de CYP3A4 porque la dosis requerida para conseguir una concentración necesaria en la sangre se reduce.[4]
Un ejemplo de la utilización de este efecto en los medicamentos actuales es la coadministración de ritonavir, un potente inhibidor de la CYP3A4 y CYP2D6 isoformas de citocromo P450, con otras drogas antirretrovirales. Aunque ritonavir inhibe la replicación del VIH en su propio derecho su uso en estos regímenes de tratamiento es para mejorar la biodisponibilidad de otros agentes a través de la inhibición de las enzimas que loa metabolizan.
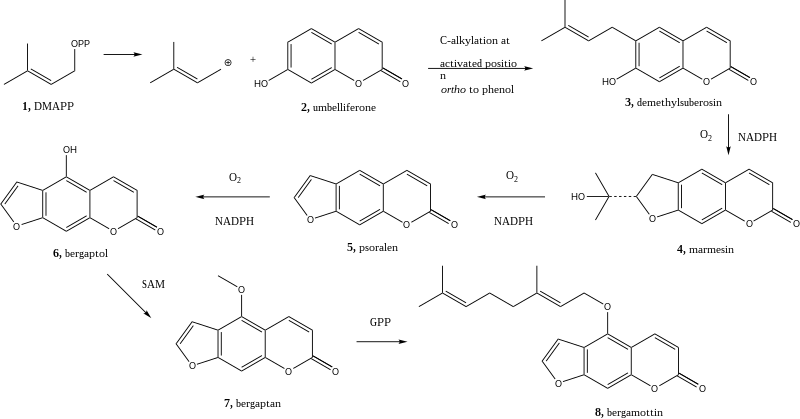
Biosíntesis de Bergamoteno
Bergamoteno se deriva de los componentes originarios de la vía siquimato.[5] La biosíntesis de este compuesto se inicia con la formación de la demethylsuberosin (3), producto, que se forma a través de la alquilación del (2) compuesto de umbeliferona.[6] La alquilación de la umbeliferona se inicia con el uso de pirofosfato de dimetilalilo, conocido más comúnmente como DMAPP. La ciclación de un grupo alquilo se produce para formar marmesin (4), que se realiza en presencia de NADPH y oxígeno junto con un catalizador de monooxigenasa citocromo P450.[7] Este proceso se repite después dos veces más, primero para eliminar el sustituyente de hidroxiisopropilo marmesin (4) para formar psoraleno (5), y luego añadir un grupo hidroxilo para formar bergaptol (6).[8] Bergaptol (6) está al lado metilado con S-adenosil metionina (SAM) para formar bergapteno (7). El paso final en esta biosíntesis es la unión de un GPP, o pirofosfato de geranilo, al bergapten recién metilado (7) para formar la molécula diana bergamotina (8).
Referencias
- ↑ Número CAS
- ↑ David G. Bailey, J. Malcolm, O. Arnold, J. David Spence (1998). «Grapefruit juice-drug interactions». Br J Clin Pharmacol 46 (2): 101-110. PMC 1873672. PMID 9723817. doi:10.1046/j.1365-2125.1998.00764.x.
- ↑ E. C. Row, S. A. Brown, A. V. Stachulski and M. S. Lennard (2006). «Design, synthesis and evaluation of furanocoumarin monomers as inhibitors of CYP3A4». Org. Biomol. Chem. 4 (8): 1604-1610. PMID 16604230. doi:10.1039/b601096b.
- ↑ Christensen, Hege; Asberg, Anders; Holmboe, Aase-Britt; Berg, Knut Joachim (2002). «Coadministration of grapefruit juice increases systemic exposure of diltiazem in healthy volunteers». European Journal of Clinical Pharmacology 58 (8): 515-520. PMID 12451428. doi:10.1007/s00228-002-0516-8.
- ↑ Dewick, P. Medicinal Natural Products:A Biosynthetic Approach, 2nd ed., Wiley&Sons: West Sussex, England, 2001, p 145.
- ↑ Bisagni, E. Synthesis of psoralens and analogues. J. Photochem. Photobiol. B. 1992, 14, 23-46.
- ↑ Voznesensky, A. I.; Schenkman, J. B. The cytochrome P450 2B4-NADPH cytochrome P450 reductase electron transfer complex is not formed by charge-pairing. J. Biol. Chem. 1992, 267, 14669-14676.
- ↑ Kent, U. M.; Lin, H. L.; Noon, K. R.; Harris, D. L.; Hollenberg, P. F. Metabolism of bergamottin by cytochromes P450 2B6 and 3A5. J. Pharmacol. Exp. Ther. 2006, 318, 992-1005.
Enlaces externos
- Esta obra contiene una traducción derivada de «Bergamottin» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.