Linfoma de células de manto
| Linfoma de células de manto | ||
|---|---|---|
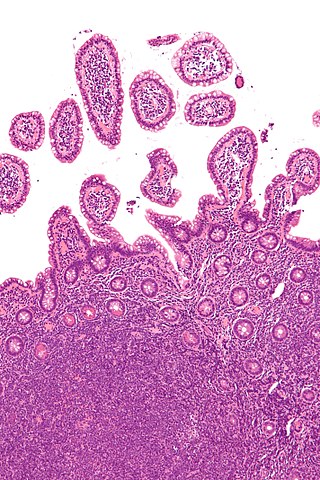 Micrografía que muestra un linfoma de células de manto (zona inferior de la imagen) en una biopsia de íleon terminal. Tinción H&E. | ||
| Especialidad | oncología | |
El linfoma de células de manto es uno de los más raros de los linfoma, con cerca de 6% de los casos de no-Hodgkins, con unos 15.000 pacientes actualmente en los Estados Unidos (el porcentaje parece ser algo más alto en Europa). Debido a que la enfermedad es difícil de tratar, raramente considerada curada, e identificada solo en la década de 1990, la investigación para encontrar tratamientos mejores se persigue activamente por todo el mundo. La supervivencia mediana de los pacientes era cerca de 3 años, pero ahora se estima cerca de los 6 años para los nuevos pacientes. LCM es un subtipo del linfoma de célula linfocito B. Las células de LCM sobreexpresan la proteína ciclina D1 debido a la translocación cromosómica t(11;14)(q13;q32), que afecta a los gen BCL1 e IgH. LCM no es contagioso. LCM implica una rotura anormal y un desplazamiento subsecuente que causa que las células se dividan tempranamente, antes de llegar a ser funcionales para combatir infecciones. Además, las células escapan a la apoptosis y por lo tanto se acumulan en el sistema linfoide. Las células afectadas LCM proliferan en patrón nodular o difuso, con dos variantes citológicos principales: típicos o "blástico".
Síntomas
Los pacientes típicos son hombres. La razón entre hombres y mujeres afectadas es cerca de 4:1. El diagnóstico típico es de un hombre de unos 60 años quien presenta enfermedad avanzada para comenzar. Síntomas incluyen fiebre, sudoración nocturna, pérdida inexplicada de peso (sobre el 10%) o una combinación. Las adenomegalias y esplenomegalia (agrandamiento patológico de los ganglios linfáticos y el bazo, respectivamente) están generalmente presentes.
Diagnóstico
El diagnóstico generalmente requiere análisis citológico de biopsias. El estudio es similar al hecho para linfomas indolentes y ciertos linfomas agresivos. El linfoma de célula de manto es una enfermedad sistémica con implicación frecuente de la médula y del aparato gastrointestinal (que generalmente demuestra poliposis). Hay también una fase leucemica no-infrecuente, marcada por presencia en la sangre. Por esta razón, la sangre periférica y la médula se evalúan para ver la presencia de células enfermas. El pecho, abdomen, y las exploraciones pélvicas usando Tomografía axial computarizada se realizan rutinariamente donde es accesible a los pacientes (el equipo y proceso de TAC son caros). La colonoscopia ahora se considera parte rutinaria de una evaluación completa. La exploración superior del sistema digestivo con endoscopia, y del cuello con TAC, puede ser provechosa en casos seleccionados. En algunos pacientes con la variante blastic, la punción lumbar se hace para evaluar el líquido espinal.
El método de diagnóstico por imágenes más preciso para evaluar linfomas es la Tomografía por emisión de positrones o PET del cuerpo entero. Muestra una imagen tridimensional donde la glucosa radiactiva, previamente inyectada, se metaboliza. El metabolismo acelerado de los tumores se muestra como área coloreada e indica que el cáncer es probable. El metabolismo de la glucosa radiactiva puede dar un falso positivo, en casos de infección e inflamación. PET también muestra la respuesta al tratamiento en curso.
Causas
No se sabe qué causa el daño del desplazamiento al gen causante de la enfermedad. La exposición a las toxinas se menciona a menudo como posibilidad. El daño del desplazamiento a un gene se requiere en solamente una célula para que el cáncer comience.
Pronóstico
El pronóstico de LCM es problemático y los índices usados para linfoma no tienden a funcionar bien debido a que los pacientes típicamente se presentan con enfermedad avanzada. La etapificacion ("staging") se usa pero no es muy informativa, puesto que las células enfermas se trasladan por el sistema linfático y por lo tanto la mayoría de los pacientes están en la etapa II o IV al primer diagnóstico.
Tratamientos
No hay estándares probados de tratamiento para LCM, y no hay consenso uniforme entre especialistas en cómo tratarlo en forma óptima. Muchos regímenes están disponibles y consiguen a menudo buenas tasas de respuesta, pero los pacientes tienden a relapsar y tener progresión de la enfermedad después de la quimioterapia original. Cada recaída es típicamente más difícil de tratar, y la recaída es generalmente cada vez más rápida. Afortunadamente, hay múltiples regímenes disponibles para tratar recaídas. Debido a los factores ya mencionados, muchos pacientes de LCM se enrolan en ensayos clínicos para conseguir los últimos tratamientos. Hay cuatro clases de tratamientos actualmente en uso general: quimioterapia, agentes biológicos (inmunoterapia), radioimmunoterapia y otros más novedosos denominados terapias dirigidas o diana.
Quimioterapia
Los tratamientos de quimioterapia se utilizan extensamente como primer tratamiento, y no se repite a menudo en la recaída debido a los efectos secundarios que tienden a ser cumulativos. La quimioterapia alterna se utiliza a veces luego de la primera recaída. Para el primer tratamiento, CHOP es la quimioterapia más común, y dado a menudo como paciente externo (sin hospitalización). Una quimioterapia más fuerte y con mayores efectos secundarios (sobre todo hematologicos) es HyperCVAD, dada a menudo hospitalizado, con Rituximab y generalmente a pacientes más aptos (algunos de quienes podrían estar sobre los 65 años). HyperCVAD está demostrando resultados prometedores, especialmente en combinación con rituximab. Otra clase de quimioterapia es monoterapia con fludarabina, combinada a veces con ciclofosfamida y mitoxatrone, generalmente con Rituximab.
Cladribina y clofarabina son otras drogas bajo investigación para LCM. PEP-C es un régimen relativamente nuevo que utiliza drogas antiguas, e incluye dosis relativamente pequeñas, tomadas en forma oral diariamente, de prednisona, etoposida, procarbazina, y ciclofosfamida. PEP-C se ha probado eficaz para pacientes recaídos. Según John Leonard M.D., investigador y proponente de PEP-C, el régimen puede tener características anti-angiogeneticas, y podría ser usado a largo plazo, algo que el y sus colegas están probando con un estudio en curso (ver en inglés, en [1]).
Otro proceso implica usar dosis muy altas de quimioterapia, combinadas a veces con irradiación total del cuerpo, para destruir toda evidencia de la enfermedad. La desventaja de este proceso es la destrucción del sistema inmune entero de los pacientes, requiriendo rescate con el llamado trasplante de médula ósea del sistema inmune de un donante. Una presentación de diciembre de 2007 de Christian Geisler, presidente del Grupo Nórdico del Linfoma [2] (Copenhague, Dinamarca), mostró que según los resultados del estudio, el linfoma de la célula de la manto es potencialmente curable con quimio-inmunoterapia muy intensiva seguida por un trasplante (medicina), cuando es tratado en forma inmediata después la primera presentación de la enfermedad [3], = (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última)..
Inmunoterapia
Inmunoterapia es ahora dominada por rituximab, el anticuerpo monoclonal ofrecido bajo el nombre comercial Rituxan (rituximab) (o como Mabthera en Europa y Australia). Puede tener buena actividad contra LCM en forma individual pero especialmente conjuntamente con quimioterapia para prolongar la duración de respuesta. Rituximab reconoce el antígeno CD20 en las células de cáncer y las marca para su destrucción. Relativamente nuevas variaciones en los anticuerpos monoclonales combinados con moléculas radiactivas son conocidas como Radioimmunoterapia. Estos compuestos incluyen Zevalin y Bexxar. Rituximab también se ha utilizado en algunos pacientes conjuntamente con thalidomida con un cierto efecto positivo.
Otros dos nuevos fármacos están siendo evaludos en el tratamiento de la LCM-MCL, particularmente anticuerpos monoclonales anti-CD-20 ((obinutuzumab y ofatumumab).[1]
Terapia dirigida o terapias diana
Nuevos agentes "dirigidos" incluyen el inhibidor de la proteasoma bortezomib (Velcade), que ya tiene aprobación de la Food and Drug Administration de EE. UU. para el tratamiento de LCM, y el inhibidor de mTor temsirolimus.[1]
En 2016 existen cuatro fármacos denominados dirigidos -diana-, los ya mencionados bortezomib y temsirolimus, y lenalidomida e ibrutinib.[2] Los cuatro han demostrado resultados prometedores en el tratamiento de MCL mejorando significativamente los pronósticos con tratamientos anteriores. Estos agentes se han aprobado en la Unión Europea (EMAA) y/o los Estados Unidos (FDA) para el tratamiento de pacientes con LCM recidivante y/o refractario. Además, el bortezomib también ha sido aprobado para pacientes no tratados previamente.[1]
Otros nuevos fármacos están siendo evaludos en el tratamiento de la LCM-MCL, entre ellos los inhibidores de Bcl-2 en BTK, PI3K (venetoclax, idelalisib).[1]
También están en ensayos clínicos la nueva generación de inhibidores del proteasoma (carfilzomib, oprozomib, ixazomib, NPI-0052).[1]
Véase también
Referencias
- Consorcio de Linfoma de la Célula de Manto
- Quimioterapia oral con combinación pep-C-(C3) para el linfoma de la célula de manto (LCM): Prednisona, etoposida, procarbazina y ciclofosphamida diarios. ASCO, 2003
- Quimioterapia oral para el linfoma relapsado con el régimen de PEP-C (C3) (prednisona, etoposida, procarbazina, cyclofosfamida diarios): terapia metronomica continua con multidroga de dosis bajas. Reunión Anual De 2007 ASCO
- ↑ a b c d e Novel therapies under investigation for mantle cell lymphoma, DOI:10.1517/13543784.2016.1152259, Tadeusz Robak Expert, Opinion on Investigational Drugs, Volume 25, Issue 4, 2016 , 26 de febrero de 2016
- ↑ Ibrutinib logra “resultados espectaculares” en leucemia crónica, redacción médica, 9 de diciembre de 2015