Perovskita (estructura)
- Este artículo trata sobre los compuestos sintéticos; para el mineral ver perovskita.
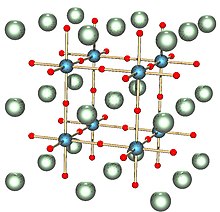

Una perovskita es cualquier material que tenga el mismo tipo de estructura cristalina que el titanato de calcio (CaTiO3), conocida como estructura de perovskita, o XIIA2+VIB4+X2−3 con el oxígeno dispuesto en los centros de las caras.[2]
Las perovskitas toman su nombre del mineral homónimo, perovskita, que fue descubierto por primera vez en 1839 en los montes Urales por Gustav Rose y que se nombró en reconocimiento del mineralogista ruso L. A. Perovski (1792–1856). La fórmula química general de los compuestos de perovskita es ABX3, donde 'A' y 'B' son dos cationes de tamaños muy diferentes y 'X' es un anión unido a ambos. Los átomos 'A' son más grandes que los átomos 'B'. La estructura de simetría cúbica ideal tiene el catión 'B' en coordinación 6 veces, rodeado por un octaedro de aniones, y el catión 'A' en coordinación cuboctaédrica de 12 veces. Los requerimientos de tamaños relativos de los iones para que la estructura cúbica sea estable son bastante rigurosos, por lo que un ligero abombamiento y/o distorsión pueden producir varias versiones distorsionadas con simetrías inferiores, en las que se reducen los números de coordinación de los cationes 'A', de los cationes 'B' o de ambos.
Los compuestos naturales con esta estructura son la perovskita, la loparita y la bridgmanita de perovskita de silicato.[2][3]
Estructura

La estructura de perovskita es adoptada por muchos óxidos que tienen la fórmula química ABO3.
En la celda unitaria cúbica idealizada de tal compuesto, el átomo del tipo 'A' se sitúa en las posiciones de esquina del cubo (0, 0, 0), el átomo del tipo 'B' se sitúa en la posición central del cuerpo (½, ½, ½) y los átomos de oxígeno se sitúan en las posiciones centradas en la cara (1/2, 1/2, 0). (El diagrama muestra los bordes de una celda unitaria equivalente con A en el centro del cuerpo, B en las esquinas y O en el borde medio).
Los requerimientos de tamaños relativos de los iones para la estabilidad de la estructura cúbica son bastante rigurosos, por lo que un ligero abollamiento y distorsión puede producir varias versiones distorsionadas con simetría inferior, en las que se reducen los números de coordinación de los cationes A, de los cationes B o de ambos. La inclinación del octaedro BO6 reduce la coordinación de un catión A desde 12 hasta 8. A la inversa, el descentrado de un catión más pequeño B en su octaedro le permite alcanzar un patrón de enlace estable. El dipolo eléctrico resultante es responsable de la propiedad de la ferroelectricidad y se muestra en perovskitas tales como el BaTiO3 que distorsionan de esta manera.
Las fases ortorrómbica y tetragonal son las variantes no cúbicas más comunes.
Las estructuras de perovskita complejas tienen dos cationes 'B' diferentes. Esto da lugar a la posibilidad de variantes ordenadas y desordenadas.
Ocurrencias más frecuentes
El mineral más común en la Tierra es la bridgmanita, un silicato rico en magnesio que adopta la estructura de perovskita a alta presión. En los minerales que contienen sílice dominante, a medida que aumenta la presión, las unidades tetraédricas de SiO44− se vuelven inestables en comparación con las unidades octaédricas de SiO68−. En las condiciones de presión y temperatura del manto inferior, el material más abundante es un mineral de estructura de perovskita de fórmula (Mg,Fe)SiO3, siendo el segundo material más abundante un óxido de estructura similar a la halita (Mg, Fe)O, periclasa.[2]
En las condiciones de alta presión del manto inferior de la Tierra, la enstatita de piroxeno, MgSiO3, se transforma en un polimorfo más denso con estructura de perovskita; esta fase puede ser el mineral más común en la Tierra.[4] Esta fase tiene la estructura de perovskita ortorrómbicamente distorsionada (estructura de tipo GdFeO3) que es estable a presiones de ~24 GPa a ~110 GPa. Sin embargo, no puede ser transportado desde las profundidades de varios cientos de kilómetros hasta la superficie de la Tierra sin transformarse de nuevo en materiales menos densos. A mayores presiones, la perovskita de MgSiO3 se transforma en post-perovskita.
Otro mineral muy frecuente en el manto, y recientemente hallado en el interior de un diameante, es la perovskita de CaSiO3. [5]
Aunque los compuestos de perovskita más comunes contienen oxígeno, hay algunos que se forman sin oxígeno, siendo bien conocidas las perovskitas de flúor, como NaMgF3. Una gran familia de compuestos de perovskitas metálicas puede representarse mediante RT3M (siendo R= tierra rara u otro ión relativamente grande; T= ión de metal de transición; y M= metaloides ligeros). Los metaloides ocupan los sitios 'B' coordinados octaédricamente en estos compuestos. RPd3B, RRh3B y CeRu3C son ejemplos. El MgCNi3 es un compuesto de perovskita metálico y ha recibido mucha atención debido a sus propiedades superconductoras. Un tipo aún más exótico de perovskita está representado por los óxidos auricos mixtos de Cs y Rb, como el Cs3AuO, que tienen grandes cationes de álcali en los sitios tradicionales de los "aniones", enlazados a los aniones O2− y Au−.
Propiedades materiales
Los materiales de perovskita muestran muchas propiedades interesantes e intrigantes desde el punto de vista teórico y de aplicación. La magnetorresistencia colosal, la ferroelectricidad, la superconductividad, el orden de carga, el transporte dependiente del spin, el alto poder térmico y la interacción de propiedades estructurales, magnéticas y de transporte son características comúnmente observadas en esta familia. Estos compuestos se utilizan como sensores y electrodos de catalizador en ciertos tipos de pilas de combustible (SOFC o Solid oxide fuel cell)[6] y son candidatos para dispositivos de memoria y en aplicaciones de espintrónica.[7]
Muchos materiales cerámicos superconductores (los superconductores de alta temperatura) tienen estructuras de tipo perovskita, a menudo con 3 o más metales incluyendo el cobre y con algunas posiciones de oxígeno vacantes. Un ejemplo principal es el YBCO (óxido itrio bario cobre) que puede ser aislante o superconductor dependiendo del contenido de oxígeno.
Los ingenieros químicos están considerando un material de perovskita a base de cobalto como sustituto del platino en los convertidores catalíticos en los vehículos diesel.[8]
Aplicaciones
Algunas propiedades físicas de interés de las perovskitas para la ciencia de los materiales son la superconductividad, la magnetoresistencia, la conductividad iónica y otras muchas propiedades dieléctricas, que son de gran importancia en microelectrónica y telecomunicaciones. Debido a la flexibilidad de los ángulos de unión inherente a la estructura de perovskita hay muchos tipos de distorsiones diferentes que pueden darse a partir de la estructura ideal, como la inclinación de los octaedros, los desplazamientos de los cationes fuera de los centros de sus poliedros de coordinación o las distorsiones de los octaedros impulsados por factores electrónicos (distorsiones Jahn-Teller).[9]
Fotovoltaicas

Las perovskitas sintéticas se han identificado como posibles materiales económicos de alta eficiencia para la industria fotovoltaica comercial,[11][12] ya que mostraron una eficiencia de conversión de hasta el 15%[12][13] y se pueden fabricar usando las mismas técnicas de fabricación de película delgada que las que usadas para las células solares de silicio.[14] Los haluros de estaño de metilamonio y los haluros de plomo de metilamonio son de interés para su uso en células solares sensibilizadas por colorantes.[15][16] En 2016, la eficiencia de la conversión de energía ha alcanzado el 21%.[cita requerida] En julio de 2016, un equipo de investigadores dirigido por Alexander Weber-Bargioni demostró que las células de perovskita PV podrían alcanzar una eficiencia máxima teórica del 31%.[17]
Entre los haluros de metilamonio estudiados hasta ahora, el más común es el triyoduro de plomo metilamonio (CH
3NH
3PbI
3). El portador de carga tiene una alta movilidad y una vida útil que permite que los electrones y los huecos generados por la luz se muevan lo suficiente como para ser extraídos como corriente, en lugar de perder su energía como calor dentro de la célula. Las longitudes de difusión efectivas de CH
3NH
3PbI
3 son de unos 100 nm, tanto para los electrones como para los huecos.[18]
Los haluros de metilamonio se depositan mediante métodos de solución a baja temperatura (típicamente, revestimiento por centrifugación, o spin-coating). Otras películas procesadas en solución a baja temperatura (por debajo de 100 °C) tienden a tener longitudes de difusión considerablemente más pequeñas. Stranks et al. han descrito células nanoestructuradas utilizando un haluro de plomo metilamonio mixto (CH3NH3PbI3−xClx) y mostraron una célula solar de película delgada amorfa con una eficiencia de conversión del 11,4% y otra que alcanzó el 15,4% usando evaporación en vacío. El espesor de la película es, aproximadamente, de 500 a 600 nm, lo que implica que las longitudes de difusión de los electrones y los huecos eran al menos de ese orden. Midieron valores de la longitud de difusión superiores a 1 μm para la perovskita mixta, un orden de magnitud mayor que los 100 nm para el yoduro puro. También mostraron que las vidas de los portadores en la perovskita mixta son más largas que en el yoduro puro.[18]
Para CH
3NH
3PbI
3, el voltaje de circuito abierto (VOC) se aproxima típicamente a 1 V, mientras que para CH
3NH
3PbI(I,Cl)
3 con bajo contenido de Cl, el VOC > 1.1 V. Debido a que las brechas de banda (Eg) de ambos son 1.55 eV, las relaciones VOC y Eg son más altas de lo que se observa normalmente en las células similares de tercera generación. Con perovskitas de brechas de banda más anchas, se han demostrado VOC de hasta 1,3 V.[18]
La técnica ofrece potencialmente un bajo costo debido a los métodos de solución a baja temperatura y a la ausencia de elementos raros. La durabilidad de estas células es actualmente insuficiente para su uso comercial.[18]
Las células solares de perovskita de heterojunción planar se pueden fabricar en arquitecturas de dispositivos simplificadas (sin nanoestructuras complejas) utilizando únicamente deposición de vapor. Esta técnica produce una conversión de energía solar a energía eléctrica del 15%, medida bajo una luz solar completamente simulada.[19]
Láseres
También en 2008 los investigadores demostraron que la perovskita puede generar luz láser. LaAlO3 dopado con neodimio dio una emisión láser a 1080 nm.[20] En 2014 se demostró que las células mixtas de haluro de plomo de metilamonio (CH3NH3PbI3−xClx) formadas por bombeo óptico en láseres de cavidad vertical de emisión de superficie (VCSELs, o vertical-cavity surface-emitting lasers) convierten la luz de visible bombeada en luz láser cercana al IR con una eficiencia del 70%.[21][22]
Diodos emisores de luz
Debido a sus altas eficiencias cuánticas de fotoluminiscencia, las perovskitas pueden ser buenas candidatas para su uso en diodos emisores de luz (LEDs).[23] Sin embargo, la propensión a la recombinación radiativa se ha observado principalmente a temperaturas del nitrógeno líquido.
Fotoelectrolisis
En septiembre de 2014, investigadores de la EPFL en Lausana (Suiza), informaron que habían logrado la electrólisis del agua con una eficiencia del 12,3% en una célula de escisión de agua altamente eficiente y de bajo costo utilizando fotovoltaicas de perovskita.[24][25]
Véase también
- Celda de yunque de diamante
- Post-perovskita
- Espinela
- Factor de tolerancia Goldschmidt
- Fase de Ruddlesden-Popper
Ejemplos de perovskitas
- Sencillas:
- Titanato de estroncio
- Titanato de calcio
- Titanato de plomo
- Ferrita de bismuto
- Óxido de lantano ytterbio
- Perovskita de silicato
- Manganita de lantano
- Manganita de estroncio de lantano
- LSAT (aluminato de lantano - tantalato de estroncio y aluminio)
- Titanato de escandio de plomo
- Titanato de zirconato de plomo
Notas
- ↑
- ↑ a b c Wenk, Hans-Rudolf; Bulakh, Andrei (2004). Minerals: Their Constitution and Origin. New York, NY: Cambridge University Press. ISBN 978-0-521-52958-7.
- ↑ Bridgemanite on Mindat.org
- ↑ John Lloyd; John Mitchinson. «What's the commonest material in the world». QI: The Book of General Ignorance. Faber & Faber. ISBN 0-571-23368-6.
- ↑ F. Nestola, N. Korolev, M. Kopylova, N. Rotiroti, D. G. Pearson, M. G. Pamato, M. Alvaro, L. Peruzzo, J. J. Gurney, A. E. Moore, J. Davidson. CaSiO3 perovskite in diamond indicates the recycling of oceanic crust into the lower mantle. Nature, 2018; 555 (7695): 237.
- ↑ Kulkarni, A; FT Ciacchi; S Giddey; C Munnings et al. (2012). «Mixed ionic electronic conducting perovskite anode for direct carbon fuel cells». International Journal of Hydrogen Energy 37 (24): 19092-19102. doi:10.1016/j.ijhydene.2012.09.141.
- ↑ J. M. D. Coey; M. Viret; S. von Molnar (1999). «Mixed-valence manganites». Advances in Physics 48 (2): 167-293. Bibcode:1999AdPhy..48..167C. doi:10.1080/000187399243455.
- ↑ Alexandra Witze (2010). «Building a cheaper catalyst». Science News Web Edition.
- ↑ Lufaso, Michael W.; Woodward, Patrick M. (2004). «Jahn–Teller distortions, cation ordering and octahedral tilting in perovskites». Acta Crystallographica Section B 60: 10. doi:10.1107/S0108768103026661.
- ↑ Eames, Christopher; Frost, Jarvist M.; Barnes, Piers R. F.; o'Regan, Brian C.; Walsh, Aron; Islam, M. Saiful (2015). «Ionic transport in hybrid lead iodide perovskite solar cells». Nature Communications 6: 7497. Bibcode:2015NatCo...6E7497E. PMC 4491179. PMID 26105623. doi:10.1038/ncomms8497.
- ↑ Bullis, Kevin (8 de agosto de 2013). «A Material That Could Make Solar Power "Dirt Cheap"». MIT Technology Review. Archivado desde el original el 1 de julio de 2019. Consultado el 8 de agosto de 2013.
- ↑ a b Li, Hangqian. (2016). «A modified sequential deposition method for fabrication of perovskite solar cells». Solar Energy 126: 243-251. doi:10.1016/j.solener.2015.12.045.
- ↑ Cartwright, Jon (11 de septiembre de 2013). «A Flat-Out Major Advance for an Emerging Solar Cell Technology». Science (journal).
- ↑ Liu, Mingzhen; Johnston, Michael B.; Snaith, Henry J. (2013). «Efficient planar heterojunction perovskite solar cells by vapour deposition». Nature 501 (7467): 395-8. Bibcode:2013Natur.501..395L. PMID 24025775. doi:10.1038/nature12509.
- ↑ Lotsch, B.V. (2014). «New Light on an Old Story: Perovskites Go Solar». Angew. Chem. Int. Ed. 53 (3): 635-637. doi:10.1002/anie.201309368.
- ↑ Service, R. (2013). «Turning Up the Light». Science 342 (6160): 794-797. doi:10.1126/science.342.6160.794.
- ↑ http://factor-tech.com/green-energy/23404-nanoscale-discovery-could-push-perovskite-solar-cells-to-31-efficency/
- ↑ a b c d Hodes, G. (2013). «Perovskite-Based Solar Cells». Science 342 (6156): 317-318. Bibcode:2013Sci...342..317H. PMID 24136955. doi:10.1126/science.1245473.
- ↑ Liu, M.; Johnston, M. B.; Snaith, H. J. (2013). «Efficient planar heterojunction perovskite solar cells by vapour deposition». Nature 501 (7467): 395-8. Bibcode:2013Natur.501..395L. PMID 24025775. doi:10.1038/nature12509.
- ↑ Dereń, P. J.; Bednarkiewicz, A.; Goldner, Ph.; Guillot-Noël, O. (2008). «Laser action in LaAlO3:Nd3+ single crystal». Journal of Applied Physics 103 (4): 043102. Bibcode:2008JAP...103d3102D. doi:10.1063/1.2842399.
- ↑ Wallace, John (28 March 2014) High-efficiency perovskite photovoltaic material also lases. LaserFocusWorld
- ↑ «Study: Perovskite solar cells can double as lasers». Rdmag.com. 28 de marzo de 2014. Consultado el 24 de agosto de 2014.
- ↑ Stranks, Samuel D.; Snaith, Henry J. (1 de mayo de 2015). «Metal-halide perovskites for photovoltaic and light-emitting devices». Nature Nanotechnology (en inglés) 10 (5): 391-402. ISSN 1748-3387. doi:10.1038/nnano.2015.90.
- ↑ Jingshan Luo (26 de septiembre de 2014). «Water photolysis at 12.3% efficiency via perovskite photovoltaics and Earth-abundant catalysts». Science 345 (6204): 1593-1596. Bibcode:2014Sci...345.1593L. PMID 25258076. doi:10.1126/science.1258307.
- ↑ «Harvesting hydrogen fuel from the Sun using Earth-abundant materials». Phys.org. 25 de septiembre de 2014. Consultado el 26 de septiembre de 2014.
Referencias
- Esta obra contiene una traducción derivada de «Perovskite (structure)» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
Bibliografía
- Tejuca, Luis G (1993). Properties and applications of perovskite-type oxides. New York: Dekker. p. 382. ISBN 0-8247-8786-2.
- Mitchell, Roger H (2002). Perovskites modern and ancient. Thunder Bay, Ontario: Almaz Press. p. 318. ISBN 0-9689411-0-9.
Enlaces externos
- «Cubic Perovskite Structure». Center for Computational Materials Science. U.S. Naval Research Laboratory. Archivado desde el original el 8 de octubre de 2008. (Incluye un applet de JAVA con el que la estructura se puede rotar interactivamente
- Halogenuro, haluro o halida de metilamonio (en inglés)