Acide gluconique
| Acide gluconique | |
| |
 Acide gluconique |
|
| Identification | |
|---|---|
| Synonymes |
Acide D-gluconique[1] |
| No CAS | |
| No ECHA | 100.007.639 |
| No CE | 208-401-4 |
| No E | E574 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
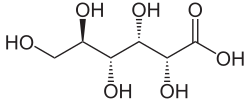
| Formule | C6H12O7 [Isomères] |
| Masse molaire[3] | 196,155 3 ± 0,007 7 g/mol C 36,74 %, H 6,17 %, O 57,1 %, |
| pKa | 3,86 [2] |
| Propriétés physiques | |
| T° fusion | 131 °C[4] |
| Solubilité | 3,16×105 mg·L-1 à 25 °C[4] |
| Masse volumique | 1,23 à 20 °C[5] |
| Propriétés optiques | |
| Indice de réfraction | 1.4161[6] |
| Précautions | |
| SIMDUT[7] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | ~ 7 630 mg·kg-1 lapin (gluconate de sodium)[5] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide gluconique (C6H12O7) est un acide très répandu aussi bien chez les animaux que dans les plantes. Il est le plus souvent intégré dans une molécule plus grande comme c'est le cas dans diverses gommes. Il est obtenu à partir de la gomme d'acacia, à partir de laquelle on l'isole sous la forme de cristaux en aiguilles fondant à 165 °C. Il est soluble dans l'eau et l'alcool[8]. Il est autorisé en Europe comme additif alimentaire (E574[9]).
Propriétés chimiques
L'acide gluconique est obtenu par l'oxydation de la fonction aldéhyde du glucose, donc sur le carbone no 1, selon la réaction suivante :
Cet acide se dissocie dans l'eau à pH = 7, selon cette réaction :
Acide gluconique et vin
L’acide gluconique a été trouvé dans les vins de vendanges eudémisées : la larve de l’eudémis (un papillon) perce le grain de raisin et permet le développement d’une bactérie oxydante.
Botrytis cinerea est capable, par l’intermédiaire d’une enzyme, la glucose oxydase, de former de l’acide gluconique à partir de glucose (en passant par le Glucono delta-lactone). Cet acide provient de la fonction aldéhyde du glucose :
On retrouve dans les moûts des teneurs en acide gluconique entre un et plusieurs centaines de milligrammes par litre. C'est l'ion D-gluconate qui est dosé dans les moûts, du fait des conditions acides et aqueuses du milieu.
Notes et références
- « ESIS (European chemical Substances Information System). », sur jrc.it via Wikiwix (consulté le ).
- Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) ChemIDplus, « Gluconic acid - RN: 526-95-4 », sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine (consulté le ).
- (en) Commission européenne - European chemicals bureau, « Substance ID 526-95-4 », IUCLID-DataSheets, sur ecb.jrc.ec.europa.eu, (consulté le ), p. 1-16 [PDF]
- https://www.sigmaaldrich.com/US/en/product/aldrich/g1951
- « Acide gluconique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Commission des Communautés Européennes, « Directive 2008/84/CE DE LA commission du 27 août 2008 portant établissement de critères de pureté spécifiques pour les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel de l'Union européenne, no L 253, , p. 1-175 (lire en ligne) [PDF]
- Parlement européen et Conseil de l'europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel de l'Union européenne, no L 61, , p. 1-56 (lire en ligne). [PDF]











