Charlesov zakon
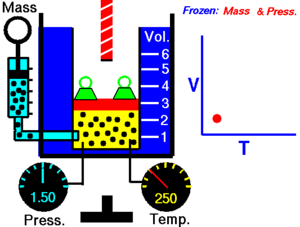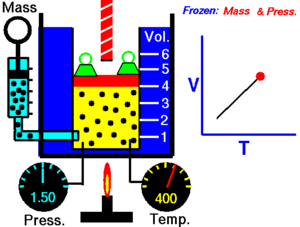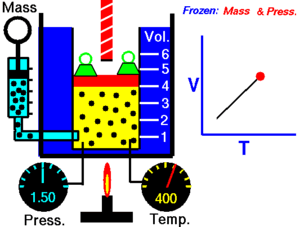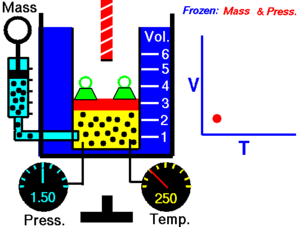
Gay-Lussacov zakon. Charlesov zakon , ili plinski zakon obujma , objavljen 1787. (Jacques Charles ). On govori da je obujam V kod idealnog plina , kada je tlak konstantan, direktno srazmjeran (proporcionalan) apsolutnoj ili termodinamičkoj temperaturi T (u Kelvinima ). Ako plinu povećavamo temperaturu, povećat će se i obujam. Matematički se taj zakon može opisati kao:
V
=
k
2
T
{\displaystyle V=k_{2}T\,}
gdje je: T - apsolutna ili termodinamička temperatura (K ), V – obujam plina (m3 ) i k2 – konstanta (u m3 /K).
Charlesov zakon se može matematički napisati i na drugi način:
V
1
T
1
=
V
2
T
2
i
l
i
V
2
V
1
=
T
2
T
1
i
l
i
V
1
T
2
=
V
2
T
1
{\displaystyle {\frac {V_{1}{T_{1}={\frac {V_{2}{T_{2}\qquad \mathrm {ili} \qquad {\frac {V_{2}{V_{1}={\frac {T_{2}{T_{1}\qquad \mathrm {ili} \qquad V_{1}T_{2}=V_{2}T_{1}
Taj se plinski zakon (Charlesov zakon) ponekad pripisuje J. L. Gay-Lussacu , koji ga je prvi matematički opisao 1802. (Gay-Lussacov zakon ).[ 1]
Gay-Lussacov zakon
Gay-Lussacov zakon kaže da uz konstantni tlak p :
V
T
=
k
o
n
s
t
.
{\displaystyle {\frac {V}{T}=konst.}
V
∼
T
V
T
=
konst.
V
1
V
2
=
T
1
T
2
{\displaystyle V\sim T\qquad \qquad {\frac {V}{T}={\text{konst.}\qquad \qquad {\frac {V_{1}{V_{2}={\frac {T_{1}{T_{2}
V
(
T
)
=
V
0
(
1
+
γ
0
[
T
−
T
0
]
)
uz
γ
0
=
1
T
0
=
1
273
,
15
K
{\displaystyle V(T)=V_{0}\left(1+\gamma _{0}[T-T_{0}]\right)\qquad {\text{uz}\qquad \gamma _{0}={\frac {1}{T_{0}={\frac {1}{273{,}15\ \mathrm {K} }
Izvori
Poveznice
The article is a derivative under the Creative Commons Attribution-ShareAlike License .
A link to the original article can be found here and attribution parties here
By using this site, you agree to the Terms of Use . Gpedia ® is a registered trademark of the Cyberajah Pty Ltd




![{\displaystyle V(T)=V_{0}\left(1+\gamma _{0}[T-T_{0}]\right)\qquad {\text{uz}\qquad \gamma _{0}={\frac {1}{T_{0}={\frac {1}{273{,}15\ \mathrm {K} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea8c35337f38394ae6ddc3b10f66e8e2c2e71e9f)