Vízmodell

A számítógépes kémiában a vízmodellek a molekulákra ható vízkörnyezet figyelembevételére, a hidratáció leírására szolgálnak. Vízklaszterek, vizes oldatok és a folyékony víz szerkezeti és termodinamikai viszonyai írhatók le segítségükkel. A modellalkotáshoz szükséges paramétereket kvantumkémiai számításokból, molekulamechanikai szimulációkból, kísérleti adatokból, valamint ezek kombinációjából származtatják. Nagyszámú vízmodell létezik, amelyeket az alábbi tulajdonságaik alapján csoportosíthatunk:
- konkrét vízmolekulák jelenléte szerint: explicit, implicit vagy hibrid vízmodell (explicit-implicit vízmodell)
- a bennük lévő kölcsönhatási pontok száma szerint: 2-6, vagy akár több (pl. BK3 vízmodell[1]) kölcsönhatási ponttal bíró vízmodellek
- a vízmodell rigiditása szerint: merev vagy flexibilis vízmodellek
- a vízmodell polarizálhatósága szerint: nem-polarizálható, polarizálható vízmodellek.
Implicit vízmodell
Olyan kvantumkémiai vagy molekulamechanikai számolásban, ahol a vízkörnyezetet folytonos modell segítségével veszik figyelembe, az egyedi vízmolekulák nincsenek reprezentálva, csak az általuk kiváltott átlagolt hatás jelentkezik. Ilyen egyszerű modellek a polarizálható kontinuum modellek (PCM). Ezen modellek sok esetben nem képesek reprodukálni a kísérleti értékeket, mivel az erősen kötött vizeket a kiátlagolás teljesen elhanyagolja. Az implicit vízmodellek hatékonysága kisszámú explicit víz segítségével javítható (hibrid modell).
Explicit vízmodell
Olyan kvantumkémiai vagy molekulamechanikai számolásban, ahol a vízkörnyezetet annak szerkezetével reprezentálja. A modellek a kölcsönhatási pontok száma szerint csoportosíthatóak. Jellemző hogy a kölcsönhatási pontok egybeesnek vízmolekula valamely atomjával (H, O), de ez nem szükségszerű (M vagy L). Néhány modelltípus az oxigén nemkötő elektronpárjait (L) szintén kölcsönhatási pontokkal reprezentálja.
2 kölcsönhatási ponttal bíró modellek
3 kölcsönhatási ponttal bíró modellek
Az alábbi táblázatban a legfontosabb 3 kölcsönhatási ponttal bíró modellek paramétereit tartalmazza.
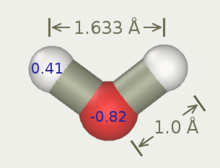
| TIPS[2] | SPC[3] | TIP3P[4] | SPC/E[5] | SPC/E |
|---|---|---|---|---|
| r(OH), Å | 0,9572 | 1,0 | 0,9572 | 1,0 |
| HOH, fok | 104,52 | 109,47 | 104,52 | 109,47 |
| × 10-3, kcal Å12/mol | 580,0 | 629,4 | 582,0 | 629,4 |
| B, kcal Å6/mol | 525,0 | 625,5 | 595,0 | 625,5 |
| q(O) | -0,80 | -0,82 | -0,834 | -0,8476 |
| q(H) | +0,40 | +0,41 | +0,417 | +0,4238 |
Az SPC/E modell tartalmaz egy átlagos polarizáció korrekciót is:
Flexibilis SPC vízmodell
További modellek
- Ferguson (flexibilis modell SPC)
- CVFF (flexibilis modell)
- MG (rugalmas, disszociatív)
- KKY potenciál (flexibilis modell).
- BLXL (nem ponttöltéses potenciál).
4 kölcsönhatási ponttal bíró modellek
| Paraméterek | BF[6] | TIPS2[7] | TIP4P | TIP4P-Ew[8] | TIP4P/ICE[9] | TIP4P/2005[10] | OPC[11] | TIP4P-D[12] |
|---|---|---|---|---|---|---|---|---|
| r(OH), Å | 0,96 | 0,9572 | 0,9572 | 0,9572 | 0,9572 | 0,9572 | 0,8724 | 0,9572 |
| HAHH, fok | 105,7 | 104,52 | 104,52 | 104,52 | 104,52 | 104,52 | 103,6 | 104,52 |
| r(OM), Å | 0,15 | 0,15 | 0,15 | 0,125 | 0,1577 | 0,1546 | 0,1594 | 0,1546 |
| × 10-3, kcal Å12/mol | 560,4 | 695,0 | 600,0 | 656,1 | 857,9 | 731,3 | 865,1 | 904,7 |
| B, kcal Å6/mol | 837,0 | 600,0 | 610,0 | 653,5 | 850,5 | 736,0 | 858,1 | 900,0 |
| q(M) | -0,98 | -1,07 | -1,04 | -1,04844 | -1,1794 | -1,1128 | -1,3582 | -1,16 |
| q(H) | +0,49 | +0,535 | +0,52 | +0,52422 | +0,5897 | +0,5564 | +0,6791 | +0,58 |
- TIP4PF (flexibilis)
5 kölcsönhatási ponttal bíró modellek
| BNS[13] | ST2 | TIP5P[14] | TIP5P-E[15] | |
|---|---|---|---|---|
| r(OH), Å | 1,0 | 1,0 | 0,9572 | 0,9572 |
| HOH, fok | 109,47 | 109,47 | 104,52 | 104,52 |
| r(OL), Å | 1,0 | 0,8 | 0,70 | 0,70 |
| LOL, fok | 109,47 | 109,47 | 109,47 | 109,47 |
| × 10-3, kcal Å12/mol | 77,4 | 238,7 | 544.5 | 554,3 |
| B, kcal Å6/mol | 153,8 | 268,9 | 590.3 | 628,2 |
| q(L) | -0,19562 | -0,2357 | -0.241 | -0,241 |
| q(H) | +0,19562 | +0,2357 | +0.241 | +0,241 |
| RL, Å | 2,0379 | 2,0160 | ||
| RU, Å | 3,1877 | 3,1287 |
A BNS, ST2 modellek a Coulomb-törvényt a S(r) függvénnyel módosítva veszik figyelembe, oly módon hogy az kis távolságok esetén leskálázza:
Jegyzetek
- ↑ Péter T. Kiss and András Baranyai: A systematic development of a polarizable potential of water http://aip.scitation.org/doi/abs/10.1063/1.4807600?journalCode=jcp
- ↑ Jorgensen, W. L. (1981). „Transferable intermolecular potential functions for water, alcohols, and ethers. Application to liquid water”. J. Am. Chem. Soc. 103, 335-340. o. DOI:10.1021/ja00392a016.
- ↑ H.J.C. Berendsen, J.P.M. Postma, W.F. van Gunsteren, and J. Hermans, In Intermolecular Forces, edited by B. Pullman (Reidel, Dordrecht, 1981), p. 331.
- ↑ Jorgensen, W. L. (1983). „Comparison of simple potential functions for simulating liquid water”. J. Chem. Phys 79, 926–935. o. DOI:10.1063/1.445869.
- ↑ Berendsen, H. J. C. (1987). „The missing term in effective pair potentials”. J. Phys. Chem 91, 6269–6271. o. DOI:10.1021/j100308a038.
- ↑ Bernal, J. D. (1933). „A Theory of Water and Ionic Solution, with Particular Reference to Hydrogen and Hydroxyl Ions”. J. Chem. Phys. 1, 515. o. DOI:10.1063/1.1749327.
- ↑ Jorgensen (1982). „Revised TIPS for simulations of liquid water and aqueous solutions”. J. Chem. Phys 77, 4156–4163. o. DOI:10.1063/1.444325.
- ↑ Horn, H. W. (2004). „Development of an improved four-site water model for biomolecular simulations: TIP4P-Ew.”. J. Chem. Phys. 120, 9665–9678. o. DOI:10.1063/1.1683075.
- ↑ Abascal, J. L. F. (2005). „A potential model for the study of ices and amorphous water: TIP4P/Ice”. J. Chem. Phys. 122, 234511. o. DOI:10.1063/1.1931662.
- ↑ Abascal, J. L. F. (2005). „A general purpose model for the condensed phases of water: TIP4P/2005”. J. Chem. Phys. 123, 234505. o. DOI:10.1063/1.2121687.
- ↑ Izadi, S. (2014). „Building Water Models: A Different Approach”. The Journal of Physical Chemistry Letters 5 (21), 3863–3871. o. DOI:10.1021/jz501780a.
- ↑ Piana, Stefano (2015). „Water Dispersion Interactions Strongly Influence Simulated Structural Properties of Disordered Protein States”. The Journal of Physical Chemistry B 119, 150312133835006. o. DOI:10.1021/jp508971m. ISSN 1520-6106.
- ↑ Stillinger, F.H. (1974). „Improved simulation of liquid water by molecular dynamics”. J. Chem. Phys. 60, 1545–1557. o. DOI:10.1063/1.1681229.
- ↑ Mahoney, M. W. (2000). „A five-site model for liquid water and the reproduction of the density anomaly by rigid, nonpolarizable potential functions”. J. Chem. Phys. 112, 8910–8922. o. DOI:10.1063/1.481505.
- ↑ Rick, S. W. (2004). „A reoptimization of the five-site water potential (TIP5P) for use with Ewald sums”. J. Chem. Phys. 120, 6085–6093. o. DOI:10.1063/1.1652434.

