Catalizzatore di Crabtree
| Catalizzatore di Crabtree | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| esafluoridofosfato(1−) di (SP-4)tris(cicloesil)fosfano [(1-2-η:5-6-η)-ciclootta-1,5-diene] piridinairidio(1+) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C31H50F6IrNP2 |
| Massa molecolare (u) | 804,89 |
| Aspetto | solido cristallino arancione |
| Numero CAS | |
| Numero EINECS | 636-356-4 |
| PubChem | 2734563 |
| SMILES | C1CCC(CC1)P(C2CCCCC2)C3CCCCC3.C1CC=CCCC=C1.C1=CC=NC=C1.F[P-](F)(F)(F)(F)F.[Ir] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,67 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 175 °C (448 K) dec |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 36/38 |
| Frasi S | 26-37 |
Catalizzatore di Crabtree è il nome comune del complesso di iridio [Ir(COD)(PCy3)(py)]+, dove l'iridio in stato di ossidazione +1 è legato a 1,5-cicloottadiene (COD), tris-cicloesilfosfina (PCy3) e piridina (py). In condizioni normali si presenta come un solido cristallino arancione. I leganti circondano l'atomo di iridio con una geometria planare quadrata, come atteso per uno ione d8. Il complesso è un catalizzatore omogeneo per reazioni di idrogenazione,[1] ed è stato sviluppato da Robert H. Crabtree all'Università di Yale.[2]
Questo catalizzatore fu scoperto negli anni settanta all'Istituto di Chimica delle Sostanze Naturali di Gif-sur-Yvette, vicino a Parigi, dove Crabtree e lo studente laureato George Morris stavano lavorando su composti di iridio analoghi al catalizzatore di Wilkinson, che è a base di rodio. Uno dei vantaggi del catalizzatore di Crabtree è che è circa 100 volte più attivo di quello di Wilkinson, e può idrogenare anche alcheni tri- e tetrasostituiti.
Il catalizzatore di Crabtree è stato usato anche come base per lo sviluppo di ulteriori catalizzatori, dato che modificando i leganti si possono variare le proprietà del catalizzatore. Ad esempio, l'uso di leganti chirali ha permesso lo sviluppo di catalizzatori enantioselettivi.
Confronto con catalizzatori tradizionali
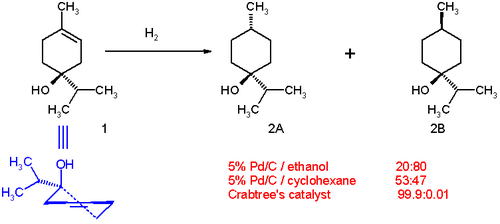
Nella reazione di idrogenazione di alcuni terpen-4-oli si osserva che:[3]
- Usando come catalizzatore palladio su carbone (Pd/C) in etanolo il prodotto principale della reazione è l'isomero trans (rapporto 20:80, composto 2B nello schema seguente). Il lato polare con il gruppo idrossilico interagisce con il solvente polare e il lato apolare è libero di interagire con la superficie del catalizzatore.
- Usando il solvente apolare cicloesano la distribuzione diventa 53:47 indicando che il lato polare ha una leggera preferenza per il catalizzatore.
- Usando il catalizzatore di Crabtree in diclorometano la distribuzione dei prodotti cambia totalmente a favore dell'isomero cis 2A. Questo effetto direzionante è dovuto all'interazione di legame tra il gruppo idrossilico e il centro di iridio. Anche i gruppi carbonilici mostrano lo stesso effetto direzionante nelle reazioni di idrogenazione con il catalizzatore di Crabtree.
Sicurezza
Il composto è irritante per la pelle e gli occhi. Non ci sono dati che indichino proprietà cancerogene. Non è considerato pericoloso per l'ambiente.[4]
Note
- ^ Brown 1987
- ^ Crabtree 1979
- ^ Crabtree e Davis 1986
- ^ Alfa Aesar, Scheda di dati di sicurezza del catalizzatore di Crabtree (PDF), su alfa.com. URL consultato l'11 ottobre 2011.
Bibliografia
- J. M. Brown, Directed homogeneous hydrogenation, in Angew. Chem. Int. Ed., vol. 26, n. 3, 1987, pp. 190–203, DOI:10.1002/anie.198701901. URL consultato il 10 ottobre 2011.
- R. Crabtree, Iridium compounds in catalysis, in Acc. Chem. Res., vol. 12, n. 9, 1979, pp. 331–337, DOI:10.1021/ar50141a005. URL consultato il 10 ottobre 2011.
- R. H. Crabtree, M. W. Davis, Directing effects in homogeneous hydrogenation with [Ir(cod)(PCy3)(py)]PF6, in J. Org. Chem., vol. 51, n. 14, 1986, pp. 2655–2661, DOI:10.1021/jo00364a007. URL consultato il 10 ottobre 2011.
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Catalizzatore di Crabtree
Wikimedia Commons contiene immagini o altri file su Catalizzatore di Crabtree