二硫化物

二硫化物(にりゅうかぶつ)とは、二硫化物イオン (S2−
2) を構成要素として含む塩、化合物の総称。多硫化物(ポリ硫化物)の範疇に含まれる。「二硫化物」という表現は主に無機化合物や金属錯体に関して用いられ、一方「R-S-S-R」という一般式で表される有機化合物はもっぱら「ジスルフィド (disulfide)」と呼ばれる。なお、英語では無機、有機化合物のいずれも disulfide と呼ばれる。
二硫化物の代表例として 二硫化ナトリウム (Na2S2) 、黄鉄鉱を作る二硫化鉄 (FeS2) などが挙げられる。いずれも構造中に S-S 結合を含む。
一方、二硫化炭素や二硫化モリブデン(硫化モリブデン(IV))などは、その構造に S-S 結合を含まない。そのような、化学式に S2 を含み「二硫化~」と呼称されるが S-S 結合を持たない化合物は、二硫化物ではなく硫化物の範疇に入る。
二硫化物イオン
二硫化物を形成する陰イオン、二硫化物イオン (S2−
2, disulfide ion) は、硫化物イオン (S2-) に単体の硫黄を作用させると生じる。二硫化ナトリウムは硫化ナトリウムに硫黄を加えて調製する。
二硫化物イオンにさらに硫黄を加えると、さらに S-S 結合が伸びた多硫化物イオン(ポリ硫化物イオン)が生成する。
二硫化物イオンにハロゲン化アルキルを加えると有機ジスルフィドが生成する。
錯体の構造
二硫化物イオンを配位子とする錯体では、ほとんどの場合イオンは2個以上の金属に結合しており、さらにその多くでジグザグ状の M-S-S-M 型をとっている。少数の例として、二硫化物イオンがη2型で1個の金属に配位している錯体(例: Os(S2)(CO)2(PPh3)2)、M-S-M 構造を含むμ型の錯体(例: Cp*2Cr2S5)が知られる[1]。
ハロゲン化物
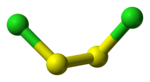
二塩化二硫黄 (S2Cl2) は市販もされている化合物で、溶融した単体硫黄に塩素分子を作用させると得られる橙色の液体である。これはゴムの加硫に利用され、分子構造は Cl-S-S-Cl、2本の S-Cl 結合は二面角103°と曲がっている[1]。二臭化二硫黄 S2Br2 も存在と構造が知られた化合物である。
水素化物
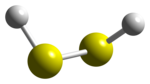
二硫化ナトリウムを塩酸で処理すると、二硫化水素(H2S2)が発生する。
二硫化水素を単離することは可能だが、熱的に不安定であり硫化水素と単体硫黄に分解する[1]。
類縁体
他の16族元素も硫黄と同様に X2−
2 (X = O, Se, Te) を含む化合物が知られる。過酸化ナトリウム (Na2O2) は強い酸化剤として、二セレン化ナトリウム (Na2Se2) はジセレニド (R-Se-Se-R) の合成試剤として用いられる。



