Karbonat
| |
| Nama | |
|---|---|
| Nama IUPAC sistematik
Karbonat | |
| Pengecam | |
| Sifat | |
| CO2− 3 | |
| Jisim molar | 60.01 g mol-1 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| Rujukan kotak info | |
Dalam kimia, karbonat ialah garam asid karbonik yang dicirikan dengan kewujudan ion karbonat, CO2−
3. Namanya juga boleh membawa maksud ester kepada asid karbonik, iaitu sebatian organik yang mengandungi kumpulan karbonat C(=O)(O-)2.
Istilah ini juga digunakan sebagai kata kerja untuk menerangkan pengkarbonatan: proses meningkatkan kepekatan ion karbonat dan bikarbonat dalam air untuk menghasilkan air berkarbonat dan minuman berkarbonat yang lain, sama ada dengan cara penambahan gas karbon dioksida bertekanan, atau dengan melarut garam karbonat atau bikarbonat dalam air.
Dalam geologi dan mineralogi, istilah "karbonat" boleh merujuk kepada mineral karbonat dan batu karbonat (yang terbentuk terutamanya daripada mineral karbonat), dan kedua-duanya mengandungi banyak ion karbonat, CO2−
3. Terdapat berbagai-bagai jenis mineral karbonat dan ia melata dalam batuan endapan yang dimendak secara kimia. Mineral karbonat yang paling biasa ialah kalsit atau kalsium karbonat, CaCO3, komponen utama batu kapur, cangkerang moluska dan batu karang; dolomit, sejenis karbonat kalsium-magnesium, CaMg(CO3)2; dan siderit, atau ferum(II) karbonat, FeCO3, bijih besi yang penting. Natrium karbonat (soda) dan kalium karbonat (potasy) telah digunakan sejak dahulu lagi untuk kerja-kerja pembersihan dan pemeliharaan, serta dalam penghasilan kaca. Karbonat banyak digunakan dalam industri, misalnya untuk melebur besi, sebagai bahan mentah untuk pengeluaran simen Portland dan kapur, dalam komposisi saduran seramik, dan sebagainya.
Struktur dan pengikatan
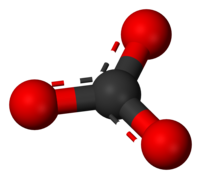
Ion karbonat ialah anion oksokarbon yang paling ringkas. Ia terdiri daripada satu atom karbon dan dikelilingi tiga atom oksigen dalam susunan pelan trigonal dengan simetri molekul D3h. Ia mempunyai jisim molekul 60.01 dalton dan membawa cas formal negatif dua. Ia adalah bes konjugat ion hidrogen karbonat (bikarbonat), HCO−
3, yang merupakan bes konjugat bagi asid karbonik, H2CO3.
Struktur Lewis bagi ion karbonat mempunyai dua ikatan tunggal (panjang) kepada atom-atom oksigen bercas negatif, dan satu satu ikatan ganda dua ke atom oksigen neutral.
Struktur ini tidak sepadan dengan simetri yang telah diperhatikan bagi ion ini yang menyatakan bahawa ketiga-tiga ikatan sama panjangnya dan ketiga-tiga atom oksigen adalah serupa. Seperti mana keadaan ion nitrat yang isoelektronik dengan ion karbonat, simetri ini boleh dicapai dengan resonans antara tiga struktur:
Resonans ini boleh diringkaskan oleh model dengan ikatan pecahan dan cas yang dinyahsetempatkan:
Ciri-ciri kimia
Karbonat logam biasanya mereput apabila dipanaskan, dan membebaskan karbon dioksida daripada kitaran karbon jangka panjang kepada kitaran karbon jangka pendek dan meninggalkan oksida logam itu. Proses ini dinamakan pengkalsinan, daripada perkatan Latin calcinare (bakar kapur) kerana kegunaan utama proses ini adalah untuk mereputkan batu kapur untuk menghasilkan simen.
Garam karbonat terbentuk apabila ion bercas positif, M+, terikat dengan atom oksigen bercas negatif ion karbonat, dan membentuk sebatian ion:
- 2 M+ + CO2−
3 → M2CO3 - M2+ + CO2−
3 → MCO3 - 2 M3+ + 3 CO2−
3 → M2(CO3)3
Kebanyakan garam karbonat tidak boleh larut dalam air pada suhu dan tekanan piawai, dengan pemalar keterlarutan kurang daripada 1 × 10-8. Pengecualian bagi ini ialah karbonat litium, natrium, kalium dan ammonium, serta kebanyakan karbonat uranium.
Dalam larutan akua, karbonat, bikarbonat, karbon dioksida dan asid karbonik wujud bersama-sama dalam keseimbangan dinamik. Dalam keadaan yang sangat bes, ion karbonat wujud paling banyak, manakala dalam keadaan bes lemah, ion bikarbonat didapati secara lazim. Dalam keadaan yang lebih berasid, karbon dioksida akua, CO2 (aq), ialah bentuk utama yang, dengan air, H2O, berada dalam keseimbangan dengan asid karbonik - keseimbangannya lebih ke arah karbon dioksida. Oleh itu, natrium karbonat bersifat bes, natrium bikarbonat bersifat bes lemah, manakala karbon dioksida sendiri adalah asid lemah. Perhatikan yang walaupun garam karbonat kebanyakan logam tidak boleh larut dalam air, garam bikarbonat boleh larut dalam air. Keseimbangan antara karbonat, bikarbonat, karbon dioksida dan asid karbonik dalam air, di bawah keadaan suhu dan tekanan yang berubah-ubah serta dengan kehadiran ion logam dengan karbonat tidak boleh larut, boleh membawa kepada pembentukan sebatian tidak boleh larut. Ini yang menyebabkan pembentukan keladak dalam paip yang disebabkan oleh air liat.



