Zwaveltrioxide
| Zwaveltrioxide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
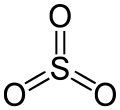
Structuurformule van zwaveltrioxide
| ||||

| ||||
Zwaveltrioxide in zuivere vaste vorm
| ||||
| Algemeen | ||||
| Molecuulformule | SO3 | |||
| Andere namen | zwavelzuuranhydride | |||
| Molmassa | 80,06 g/mol | |||
| CAS-nummer | 7446-11-9 | |||
| Wikidata | Q242715 | |||
| Vergelijkbaar met | zwavelzuur, zwaveldioxide | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P280 - P305+P351+P338 - P310 | |||
| Hygroscopisch? | ja | |||
| MAC-waarde | 0,05 mg/m³ | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,9 g/cm³ | |||
| Smeltpunt | 16,8 °C | |||
| Kookpunt | 44 °C | |||
| Dampdruk | 37330,16 Pa | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−397,77 kJ/mol | |||
| S |
256,77 J/mol·K | |||
| C |
24,02 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Zwaveltrioxide is een anorganische verbinding met als brutoformule SO3. In zuivere vorm is het een kleurloze vaste stof die bestaat in drie modificaties of allotropen:
- De γ-vorm heeft een moleculaire structuur en een smeltpunt van 16,8 °C en een vrije hoge dampdruk van 433 mmHg bij 25 °C. Het kookpunt is maar 44,8 °C.
- De β-vorm heeft de structuur van een polymeer met lineaire ketens. De stof smelt bij 32,5 °C en een wat lagere dampdruk van 344 mmHg bij 25 °C.
- De α-vorm heeft een netwerkstructuur. Het smelt bij 62 °C en heeft een lage dampdruk van 73 mmHg bij 25 °C.
Bereiding
Zwaveltrioxide kan in het laboratorium in kleine hoeveelheden bereid worden in twee stappen door de pyrolyse van natriumbisulfaat. Natriumpyrosulfaat is een tussenproduct en ontstaat door een dehydratie bij 315°C:
Nadien wordt het ontstane natriumpyrosulfaat gekraakt bij 460°C:
Ook bisulfaatzouten van andere metalen kunnen gebruikt worden, op voorwaarde dat het pyrosulfaat ervan stabiel is.
Op industriële schaal wordt de stof bereid met behulp van het contactproces. Zwaveldioxide wordt gewoonlijk verkregen door het roosten van pyriet (FeS2). Het gezuiverde SO2 wordt dan verder geoxideerd met atmosferische zuurstof bij 400 tot 600 °C met behulp van een katalysator op basis van vanadiumpentoxide geactiveerd met kaliumoxide op diatomeeënaarde of silica als drager. Platina werkt ook maar is beduidend duurder en is meer onderhevig aan vergiftigingsverschijnselen door onzuiverheden in het SO2-gas.
Het merendeel van het zwaveltrioxide dat op deze wijze wordt verkregen, wordt omgezet naar zwavelzuur. Dat geschiedt echter niet door directe toevoeging van water omdat daarbij een gevaarlijk aerosol van zwavelzuurdruppeltjes zou ontstaan. In plaats daarvan wordt het oxide in zwavelzuur zelf opgelost onder de vorming van oleum dat op zijn beurt weer verdund wordt met water onder vorming van meer zwavelzuur.
Een andere manier waarop zwaveltrioxide ontstaat is met behulp van ozon:
Historisch maakte de bereiding in het lodenkamerproces gebruik van nitreuze dampen, met name stikstofdioxide (NO2):
Toepassingen
De voornaamste toepassing van zwaveltrioxide is de vervaardiging van zwavelzuur:
Eenmaal zwaveltrioxide in zwavelzuur is opgelost, wordt pyrozwavelzuur gevormd, dat met water gehydrolyseerd wordt tot zwavelzuur:
De stof is ook uitgangsmateriaal voor de vervaardiging van fluorsulfonzuur en chloorsulfonzuur:
Samen met alcoholen ontstaan alkylsulfonzuren:
Deze reactie wordt gebruikt voor de bereiding van tensiden. Het intermediaire alkylsulfonzuur wordt dan met natronloog geneutraliseerd en zo ontstaat een alkylsulfonaat.
Zwaveltrioxide is zowel een sterk Lewis-zuur als een sterke oxidator. Het wordt ook gebruikt in rookbommen. Een druppel vloeibaar SO3 volstaat om een ruimte geheel in rook te hullen.
Toxicologie en veiligheid
Het is gevaarlijk om de alfa-vorm boven zijn smeltpunt te verwarmen, omdat daarbij de netwerkstructuur weer uiteenvalt naar de moleculaire structuur. De gamma-fase heeft echter boven 62 °C een dampdruk van een paar atmosfeer en dat kan tot ontploffingen leiden.
Bovendien is de damp van zwaveltrioxide bijzonder hygroscopisch en in contact met water vormt het zwavelzuur. Bij inademing wordt er dus zwavelzuur in de longen gevormd en dat kan ernstige gevolgen hebben (onder andere longoedeem).
Oplossingen van zwaveltrioxide in zwavelzuur worden ook wel oleum of rokend zwavelzuur genoemd. Zij moeten met grote omzichtigheid behandeld worden omdat zij bijzonder corrosief zijn. De rook die zij afgeven maakt het probleem des te erger. Deze rook is in feite een aerosol van kleine zwavelzuurdruppeltjes.










