Bor (grunnstoff)
| Bor | |||
|---|---|---|---|
 | |||
| Basisdata | |||
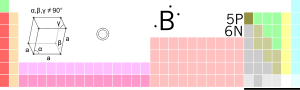
| Navn | Bor | ||
| Symbol | B | ||
| Atomnummer | 5 | ||
| Utseende | svart/brunt | ||
| Plass i periodesystemet | |||
| Gruppe | 13 | ||
| Periode | 2 | ||
| Blokk | p | ||
| Kjemisk serie | halvmetall | ||
| Atomegenskaper | |||
| Atomvekt | 10,811 u | ||
| Empirisk atomradius | 85 pm | ||
| Kalkulert atomradius | 87 pm | ||
| Kovalent atomradius | 82 pm | ||
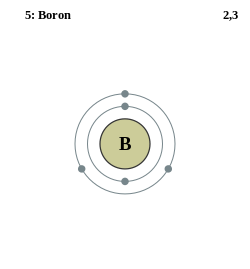
| Elektronkonfigurasjon | [He] 2s2 2p1 | ||
| Elektroner per energinivå | 2, 3 | ||
| Oksidasjonstilstander | 3 | ||
| Krystallstruktur | trigonalt rombisk | ||
| Fysiske egenskaper | |||
| Stofftilstand | fast stoff | ||
| Smeltepunkt | 2 076 °C | ||
| Kokepunkt | 3 927 °C | ||
| Molart volum | 4,68·10-5 m³/mol | ||
| Tetthet | 2 460 kg/m³ | ||
| Hardhet | 9,3 (Mohs skala) | ||
| Fordampningsvarme | 489,7 kJ/mol | ||
| Smeltevarme | 50,2 kJ/mol | ||
| Damptrykk | 0,348 Pa ved 23 K | ||
| Lydfart | 16 200 m/s ved 298,15 K | ||
| Diverse | |||
| Elektronegativitet etter Pauling-skalaen | 2,04 | ||
| Spesifikk varmekapasitet | 1 026 J/(kg·K) | ||
| Elektrisk ledningsevne | 1,0 · 10−4 S/m | ||
| Termisk konduktivitet | 27,4 W/(m·K) | ||
Bor er et grunnstoff med atomnummer 5 og kjemisk symbol B.
Historie
Forbindelser av bor (fra arabisk buraq og persisk burah) har vært kjent i tusener av år. I oldtidens Egypt ble borforbindelser brukt i mumifiseringsprosessen, og i Romerriket ble det brukt i glassproduksjon. I Kina ble borforbindelser brukt til emalje på keramikk.
Bor ble ikke isolert før 1808 av Humphry Davy, Joseph Louis Gay-Lussac og Louis Jacques Thénard. Renheten de oppnådde var ca. 50 %. Ingen av dem forsto at det dreide seg om et grunnstoff. Det var den svenske kjemikeren Jöns Jakob Berzelius som identifiserte bor som et grunnstoff i 1824. Rent bor ble første gang fremstilt av den amerikanske kjemikeren W. Weintraub i 1909.
Egenskaper
Bor er et trivalent (treverdig) halvmetall som finnes i flere allotrope former; Amorft bor er et gulaktig brunt pulver som selges for rundt 10 kr per gram. Krystallinsk bor er svart, sprøtt, overgås kun av diamant i hardhet, en relativt dårlig elektrisk leder og selges for rundt 30 kr per gram. Bor er lite reaktivt, og ikke-flyktige forbindelser er normalt ikke giftige selv når de inntas. Bor er et essensielt ultrasporstoff som er viktig for planter og dyr. Bormangel fører for eksempel ofte til at planteknopper ikke videreutvikles. Infrarød stråling stoppes ikke av bor.
Isotoper
Naturlig forekommende bor består av 2 stabile isotoper, 10B (19,9 %) og 11B (80,1 %). I tillegg finnes 12 kunstig fremstilte ustabile (og dermed radioaktive) isotoper hvorav den mest stabile er 8B med halveringstid 770 ms. Alle de resterende isotopene har halveringstider kortere enn 30 ms.[1]
CAS-nummer: 7440-42-8
Forekomst

Bor forekommer ikke i ren form naturlig, men finnes i flere oksygenholdige mineraler som boraks (Na2[B4O5(OH)4]·8H2O) og kernitt (Na2[B4O5(OH)4]·2H2O). Bor utgjør rundt 9 ppm av jordskorpen, og de største forekomstene finnes i Tyrkia.
I 2007 ble det produsert 4,3 millioner tonn boroksid på verdensbasis. De største produsentlandene var Tyrkia (2,5 millioner tonn), Argentina (650 000 tonn), Chile (460 000 tonn) og Russland (400 000 tonn). Produksjonstallene fra USA er hemmeligholdt av konkurransehensyn og er derfor ikke tatt med, men USA er en betydelig produsent av boroksid. Verdens utvinnbare reserver av bor er anslått til 170 millioner tonn, hvorav 60 millioner tonn ligger i Tyrkia. Gjenvinning av bor er ubetydelig.[2]
Anvendelse
Ulike forbindelser av bor brukes for eksempel i glassfiber, flatskjermer, solceller, og som buffer i øyedråper. Rent bor er et viktig doteringsstoff i halvledere. Bor brukes som tilsetningsstoff i rakettdrivstoff. Det brukes i fyrverkeri og gir en grønn farge.