Периодический закон

Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.
Определения
После открытия периодического закона Д. И. Менделеев два года совершенствовал его формулировку и окончательно оформил её в следующем виде (1871):
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса[1].
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1913), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.). В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку:
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений, находятся в периодической зависимости от величины зарядов ядер их атомов
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании». Графическим (табличным) выражением закона является разработанная Менделеевым периодическая система химических элементов. Всего предложено несколько сотен[2] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.).
История

Поиски основы естественной классификации и систематизации химических элементов начались задолго до открытия Периодического закона. Трудности, с которыми сталкивались естествоиспытатели, которые первыми работали в этой области, были вызваны недостаточностью экспериментальных данных: в начале XIX века число известных химических элементов было мало, а принятые значения атомных масс многих элементов неверны.
Триады Дёберейнера и первые системы элементов
В 1829 году немецкий химик Иоганн Вольфганг Дёберейнер предпринял первую значимую попытку систематизации элементов[3]. Он заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами:
| Li | Ca | P | S | Cl |
| Na | Sr | As | Se | Br |
| K | Ba | Sb | Te | I |
Сущность предложенного закона триад Дёберейнера состояла в том, что атомная масса среднего элемента триады была близка к полусумме (среднему арифметическому) атомных масс двух крайних элементов триады. Несмотря на то, что триады Дёберейнера в какой-то мере являются прообразами менделеевских групп, эти представления в целом ещё слишком несовершенны. Отсутствие магния в едином семействе кальция, стронция и бария или кислорода в семействе серы, селена и теллура является результатом искусственного ограничения совокупностей сходных элементов лишь тройственными союзами. Очень показательна в этом смысле неудача Дёберейнера выделить триаду из четырёх близких по своим свойствам элементов: P, As, Sb, Bi. Дёберейнер отчётливо видел глубокие аналогии в химических свойствах фосфора и мышьяка, сурьмы и висмута, но, заранее ограничив себя поисками триад, он не смог найти верного решения. Спустя полвека Лотар Майер скажет, что если бы Дёберейнер хоть ненадолго отвлёкся от своих триад, то он сразу же увидел бы сходство всех этих четырёх элементов одновременно.
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в соответствии с их атомными массами.
Идеи Дёберейнера были развиты другим немецким химиком Леопольдом Гмелином, который показал, что взаимосвязь между свойствами элементов и их атомными массами значительно сложнее, нежели триады. В 1843 году Гмелин опубликовал таблицу, в которой химически сходные элементы были расставлены по группам в порядке возрастания соединительных (эквивалентных) весов. Элементы составляли триады, а также тетрады и пентады (группы из четырёх и пяти элементов), причём электроотрицательность элементов в таблице плавно изменялась сверху вниз.
В 1850-х годах Макс фон Петтенкофер и Жан Дюма предложили «дифференциальные системы», направленные на выявление общих закономерностей в изменении атомного веса элементов, которые детально разработали немецкие химики Адольф Штреккер и Густав Чермак.
В начале 60-х годов XIX века появилось сразу несколько работ, которые непосредственно предшествовали Периодическому закону.
«Земная спираль» де Шанкуртуа
Александр де Шанкуртуа располагал все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность цилиндра по линии, исходящей из его основания под углом 45° к плоскости основания (лат. vis tellurique «земная спираль»)[4]. При развёртывании поверхности цилиндра оказывалось, что на вертикальных линиях, параллельных оси цилиндра, находились химические элементы со сходными свойствами. Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения. В группу щелочных металлов попадал марганец, в группу кислорода и серы — ничего общего с ними не имеющий титан.
Октавы Ньюлендса
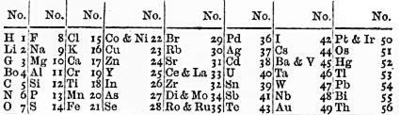
Вскоре после спирали де Шанкуртуа английский учёный Джон Ньюлендс сделал попытку сопоставить химические свойства элементов с их атомными массами[5]. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы. В своей таблице он располагал химические элементы в вертикальные группы по семь элементов в каждой и при этом обнаружил, что (при небольшом изменении порядка некоторых элементов) сходные по химическим свойствам элементы оказываются на одной горизонтальной линии.

Джон Ньюлендс, безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Он писал, что в такой последовательности повторяются свойства элементов, эквивалентные веса (массы) которых отличаются на 7 единиц, или на значение, кратное 7, то есть как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую. Ньюлендс пытался придать этой зависимости, действительно имеющей место для лёгких элементов, всеобщий характер. В его таблице в горизонтальных рядах располагались сходные элементы, однако в том же ряду часто оказывались и элементы совершенно отличные по свойствам. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица не содержала свободных мест; в итоге закон октав был принят чрезвычайно скептически.
Таблицы Одлинга и Мейера
В 1864 году Уильям Одлинг опубликовал таблицу, в которой элементы были размещены согласно их атомным весам и сходству химических свойств, не сопроводив её, однако, какими-либо комментариями.
В том же 1864 году появилась первая таблица немецкого химика Лотара Мейера; в неё были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям[6]. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах сходных элементов.
| Валентность IV | Валентность III | Валентность II | Валентность I | Валентность I | Валентность II | Разность масс | |
| I ряд | Li | Be | ~16 | ||||
| II ряд | C | N | O | F | Na | Mg | ~16 |
| III ряд | Si | P | S | Cl | K | Ca | ~45 |
| IV ряд | As | Se | Br | Rb | Sr | ~45 | |
| V ряд | Sn | Sb | Te | I | Cs | Ba | ~90 |
| VI ряд | Pb | Bi | Tl | ~90 |
В 1870 году вышла работа Мейера, содержащая новую таблицу под названием «Природа элементов как функция их атомного веса», состоявшая из девяти вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин «периодичность», уже предложенный к тому времени Менделеевым.
Открытие Периодического закона



1 марта (17 февраля) 1869 года Менделеевым был завершён самый первый целостный вариант Периодической системы химических элементов, который получил название «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»[7], в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). Эта дата знаменует собой открытие Менделеевым Периодического закона, но более верным считать эту дату началом открытия.
6 марта 1869 года (18 марта 1869 года) на заседании Русского химического общества профессором Н. А. Меншуткиным было зачитано сообщение от имени Д. И. Менделеева, в котором, как считается, было сделано сообщение об открытии Периодического закона химических элементов[8], однако по-видимому речь в это время шла более о замеченной закономерности, которая будет осмыслена учёным во время поездки конца февраля — начала марта 1869.
Согласно окончательной хронологии первых публикаций Таблицы Менделеева[9], 26-27 марта (14-15 марта) 1869 года в 1-м издании учебника Менделеева «Основы Химии» (ч. 1, вып. 2) была напечатана первая Таблица — она была утверждена вернувшимся около 10 марта в Петербург Менделеевым.
К этому времени учёный осознал и великое значение своего наблюдения, почему сразу по возвращении в Петербург Менделеев, в середине марта 1869, заказал в типографии «Общественная польза» отдельные листки с этой таблицей, которые были напечатаны 29 марта (17 марта) 1869 года специально для рассылки «многим химикам», чтобы тем самым утвердить научный приоритет Менделеева в открытии. Позднее, уже в начале мая 1869 года «Опыт системы элементов» был напечатан с химическим обоснованием в программной статье Менделеева «Соотношение свойств с атомным весом элементов»[10] (журнал Русского химического общества).
В Европе Таблица Менделеева стала известна в апреле месяце 1869 года: первая публикация Таблицы Менделеева в международной печати, согласно точной хронологии[11], вышла в свет 17 апреля (5 апреля)1869 года в лейпцигском «Журнале практической химии»[12] и стала достоянием мировой науки.
В статье, датированной 29 ноября 1870 года (11 декабря 1870 года), опубликованной в «Журнале Русского химического общества» под названием «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», Менделеев впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов[13].
В августе 1871 года Менделеев написал итоговую статью «Периодическая законность химических элементов» (нем. Die periodische Gesetzmässigkeit der Elemente) и в 1872 году опубликовал её на немецком языке в журнале Annalen der Chemie und Pharmacie. В этой работе Менделеев дал формулировку периодического закона, остававшуюся в силе на протяжении более сорока лет[14]:
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса[1].
Оригинальный текст (нем.)Die Eigenschaften der Elemente (folglich auch der aus ihnen gebildeten einfachen und zusammengesetzten Körper) befinden sich in periodischer Abhängigkeit von deren Atomgewichten[15].
Тогда же Менделеев придал своей периодической таблице вид, ставший классическим (т. н. короткопериодный вариант).
В отличие от своих предшественников, Менделеев не только составил таблицу и указал на наличие несомненных закономерностей в численных величинах атомных масс, но и решился назвать эти закономерности общим законом природы. На основании предположения, что атомная масса предопределяет свойства элемента, он взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства не открытых ещё элементов. Для предсказания свойств простых веществ и соединений Менделеев исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы (то есть сверху и снизу) и одновременно двух соседних элементов в периоде (слева и справа) (т. н. «правило звезды»).
Д. И. Менделеев на протяжении многих лет боролся за признание Периодического закона; его идеи получили признание только после того, как были открыты предсказанные Менделеевым элементы: экаалюминий, экабор и экасилиций, соответственно галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886). С середины 1880-х годов Периодический закон был окончательно признан в качестве одной из теоретических основ химии.
Развитие Периодического закона в XX веке

В начале XX века Периодическая система элементов неоднократно видоизменялась для приведения в соответствие с новейшими научными данными. Д. И. Менделеев и У. Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы[16]. Инертные газы явились, таким образом, элементами, переходными между галогенами и щелочными металлами. Б. Браунер нашёл решение проблемы размещения в таблице всех редкоземельных элементов, предложив в 1902 году помещать их в одну ячейку; в предложенном им варианте таблицы шестой период таблицы был длиннее, чем четвёртый и пятый, которые, в свою очередь, длиннее, чем второй и третий периоды.
Дальнейшее развитие Периодического закона было связано с успехами физики: установление делимости атома на основании открытия электрона и радиоактивности в конце концов позволило понять причины периодичности свойств химических элементов и создать теорию Периодической системы.
Для химии серьёзную проблему составляла необходимость размещения в Периодической таблице многочисленных продуктов радиоактивного распада, имеющих близкие атомные массы, но значительно отличающихся периодами полураспада. Т. Сведберг в 1909 году доказал, что свинец и неон, полученные в результате радиоактивного распада и отличающиеся по величине атомных масс от «обычных» элементов, химически им полностью тождественны. В 1911 году Ф. Содди предложил размещать химически неразличимые элементы, имеющие различные атомные массы (изотопы) в одной ячейке таблицы.
В 1913 году английский физик Г. Мозли установил, что корень из характеристической частоты рентгеновского излучения элемента (ν) линейно зависит от целочисленной величины — атомного номера (Z), который совпадает с номером элемента в Периодической таблице:
- , где R — постоянная Ридберга, σ — постоянная экранирования.
Закон Мозли дал возможность экспериментально определить положение элементов в Периодической таблице.
Атомный номер, совпадающий, как предположил в 1911 году голландский физик А. Ван ден Брук, с величиной положительного заряда ядра атома, стал основой классификации химических элементов. В 1920 году английский физик Дж. Чедвик экспериментально подтвердил гипотезу Ван ден Брука; тем самым был раскрыт физический смысл порядкового номера элемента в Периодической системе. Периодический закон получил современную формулировку: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер атомов элементов».
В 1921—1923 годах, основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями, Н. Бор заложил основы формальной теории Периодической системы. Причина периодичности свойств элементов, как показал Бор, заключалась в периодическом повторении строения внешнего электронного уровня атома.
Были разработаны полудлинный (см. выше) и длинный варианты Периодической Таблицы, состоящие из блоков (семейств), в которых внешние электронные орбитали атомов одинаковы по орбитальному квантовому числу (s, p, d и f). В s-блок входят щелочные и щёлочноземельные металлы, в d — переходные металлы, в f — лантаноиды и актиноиды, в p — остальные элементы.
В середине XX века В. М. Клечковский эмпирически установил и теоретически обосновал правило, описывающее последовательность заполнения электронных орбиталей атомов по мере роста заряда ядра. В отличие от предыдущих подходов, это правило учитывает взаимодействие между электронами в атоме.
Периодические свойства химических элементов
В принципе, свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, гидратированных или сольватированных, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов[17]. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
- энергия ионизации атомов;
- энергия сродства атомов к электрону;
- электроотрицательность;
- атомные (и ионные) радиусы;
- энергия атомизации простых веществ
- степени окисления;
- окислительные потенциалы простых веществ.
Проявления периодического закона в отношении энергии ионизации
Зависимость энергии ионизации атома от порядкового номера элемента (рис. 1) носит отчётливо периодический характер. Легче всего удалить электрон из атомов щелочных металлов, включающих по одному валентному электрону, труднее всего — из атомов благородных газов, обладающих замкнутой электронной оболочкой. Поэтому периодичность изменения энергии ионизации атомов характеризуется минимумами, отвечающими щелочным металлам, и максимумами, приходящимися на благородные газы. Наряду с этими резко выраженными минимумами и максимумами на кривой энергии ионизации атомов наблюдаются слабо выраженные минимумы и максимумы, которые по-прежнему нетрудно объяснить с учётом упомянутых эффектов экранирования и проникновения, эффектов межэлектронных взаимодействий и т. д[18].
Проявления периодического закона в отношении энергии сродства к электрону

Периодичность значений энергий сродства атомов к электрону объясняется, естественно, теми же самыми факторами, которые уже были отмечены при обсуждении ионизационных потенциалов (см. определение энергии сродства к электрону).
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As)[19]:
| Li | Be | B | C | N | O | F | Ne | |
|---|---|---|---|---|---|---|---|---|
| Электронная конфигурация | s1 | s2 | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Проявления периодического закона в отношении электроотрицательности

Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время всё чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Периодичность атомной электроотрицательности является важной составной частью периодического закона и легко может быть объяснена, исходя из непреложной, хотя и не совсем однозначной, зависимости значений электроотрицательности от соответствующих значений энергий ионизации и сродства к электрону[20].
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах — её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая — у p-элементов VII группы.
Проявления периодического закона в отношении атомных и ионных радиусов
Периодический характер изменения размеров атомов и ионов известен давно. Сложность здесь состоит в том, что из-за волновой природы электронного движения атомы не имеют строго определённых размеров. Так как непосредственное определение абсолютных размеров (радиусов) изолированных атомов невозможно, в данном случае часто используют их эмпирические значения. Их получают из измеренных межъядерных расстояний в кристаллах и свободных молекулах, разбивая каждое межъядерное расстояние на две части и приравнивая одну из них к радиусу первого (из двух связанных соответствующей химической связью) атома, а другую — к радиусу второго атома. При таком разделении учитывают различные факторы, включая природу химической связи, степени окисления двух связанных атомов, характер координации каждого из них и т. д[21]. Таким способом получают так называемые металлические, ковалентные, ионные и ван-дер-ваальсовы радиусы. Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов; их находят по межъядерным расстояниям в твёрдых или жидких веществах, где атомы находятся в непосредственной близости друг от друга (например, атомы Ar в твёрдом аргоне или атомы N из двух соседних молекул N2 в твёрдом азоте), но не связаны между собой какой-либо химической связью.
Но, очевидно, лучшим описанием эффективных размеров изолированного атома является теоретически рассчитанное положение (расстояние от ядра) главного максимума зарядовой плотности его наружных электронов. Это так называемый орбитальный радиус атома. Периодичность в изменении значений орбитальных атомных радиусов в зависимости от порядкового номера элемента проявляется довольно отчётливо (см. рис. 4), и основные моменты здесь состоят в наличии очень ярко выраженных максимумов, приходящихся на атомы щелочных металлов, и таких же минимумов, отвечающих благородным газам. Уменьшение значений орбитальных атомных радиусов при переходе от щелочного металла к соответствующему (ближайшему) благородному газу носит, за исключением ряда Li—Ne, немонотонный характер, особенно при появлении между щелочным металлом и благородным газом семейств переходных элементов (металлов) и лантаноидов или актиноидов. В больших периодах в семействах d- и f-элементов наблюдается менее резкое уменьшение радиусов, так как заполнение орбиталей электронами происходит в пред-предвнешнем слое. В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются.
Проявления периодического закона в отношении энергии атомизации
Энергия атомизации простых веществ является характеристикой, которая во многом определяет их реакционную способность[22]. Зависимость энергии атомизации простых веществ от порядкового номера элемента имеет периодический характер. Основные моменты такой периодической зависимости состоят в следующем: энергия атомизации растёт при переходе от щелочного металла (для них эти значения сравнительно невелики и близки 84 кДж/моль) к следующим за ним элементам, достигает максимума, затем убывает, становясь очень небольшой для галогена (63—126 кДж/моль) и, наконец, превращается в нуль в случае примыкающего к галогену благородного газа, который, как известно, при стандартных условиях существует в виде практически не взаимодействующих атомов. Положение максимума энергии атомизации в ряду элементов от щелочного металла до соответствующего (ближайшего) благородного газа зависит от многих факторов, выходящих за рамки настоящего изложения. Так, в ряду Li—Ne наибольшей энергией атомизации характеризуется углерод (718,2 кДж/моль), а в рядах K—Kr и Cs—Rn наибольшими энергиями атомизации обладают переходные металлы: ванадий (516,6 кДж/моль) и вольфрам (844,2 кДж/моль). Неравномерное изменение энергии атомизации в пределах одного ряда элементов от щелочного металла до благородного газа оказывается довольно сложным, особенно если этот ряд включает семейство переходных металлов.
Проявления периодического закона в отношении степени окисления
Одним из основных понятий в химии было и остаётся понятие степени окисления (степень окисления, состояние окисления, окислительное состояние). Несмотря на то что степень окисления представляется во многом формальной и более искусственной относительно других традиционных химических понятий, она до сих пор остаётся широко распространённой и сохраняет свою значимость для обобщения и более глубокого понимания основных принципов образования химических соединений[23].
Следует подчеркнуть, что степень окисления элемента, будучи формальной характеристикой, не даёт представления ни об эффективных зарядах атомов этого элемента в соединении, ни о валентности атомов, хотя степень окисления часто называют формальной валентностью. Многие элементы способны проявлять не одну, а несколько различных степеней окисления. Например, для хлора известны все степени окисления от −1 до +7, хотя чётные очень неустойчивы, а для марганца — от +2 до +7. Высшие значения степени окисления изменяются в зависимости от порядкового номера элемента периодически, но эта периодичность имеет сложный характер. В простейшем случае в ряду элементов от щелочного металла до благородного газа высшая степень окисления возрастает от +1 (RbF) до +8 (XeО4). В других случаях высшая степень окисления благородного газа оказывается меньше (Kr+4F4), чем для предшествующего галогена (Br+7О4−). Поэтому на кривой периодической зависимости высшей степени окисления от порядкового номера элемента максимумы приходятся или на благородный газ, или на предшествующий ему галоген (минимумы — всегда на щелочной металл). Исключение составляет ряд Li—Ne, в котором ни для галогена (F), ни для благородного газа (Ne) вообще неизвестны высокие степени окисления, а наибольшим значением высшей степени окисления обладает средний член ряда — азот; поэтому в ряду Li—Ne изменение высшей степени окисления оказывается проходящим через максимум. В общем случае возрастание высшей степени окисления в ряду элементов от щелочного металла до галогена или до благородного газа происходит отнюдь не монотонно, главным образом по причине проявления высоких степеней окисления переходными металлами. Например, возрастание высшей степени окисления в ряду Rb—Xe от +1 до +8 «осложняется» тем, что для молибдена, технеция и рутения известны такие высокие степени окисления, как +6 (MoО3), +7 (Tc2О7), +8 (RuO4).
Проявления периодического закона в отношении окислительного потенциала
| Na/Na+(aq) | Mg/Mg2+(aq) | Al/Al3+(aq) |
| 2,71В | 2,37В | 1,66В |
| K/K+(aq) | Ca/Ca2+(aq) | Sc/Sc3+(aq) |
| 2,93В | 2,87В | 2,08В |
Одной из очень важных характеристик простого вещества является его окислительный потенциал, отражающий принципиальную способность простого вещества к взаимодействию с водными растворами, а также проявляемые им окислительно-восстановительные свойства[24]. Изменение окислительных потенциалов простых веществ в зависимости от порядкового номера элемента также носит периодический характер. Но при этом следует иметь в виду, что на окислительный потенциал простого вещества оказывают влияние различные факторы, которые иногда нужно рассматривать индивидуально. Поэтому периодичность в изменении окислительных потенциалов следует интерпретировать очень осторожно.
Можно обнаружить некоторые определённые последовательности в изменении окислительных потенциалов простых веществ. В частности, в ряду металлов при переходе от щелочного к следующим за ним элементам происходит уменьшение окислительных потенциалов (Na+(aq) и т. д. — гидратированный катион):
Это легко объясняется увеличением энергии ионизации атомов с увеличением числа удаляемых валентных электронов. Поэтому на кривой зависимости окислительных потенциалов простых веществ от порядкового номера элемента имеются максимумы, отвечающие щелочным металлам. Но это не единственная причина изменения окислительных потенциалов простых веществ.
Внутренняя и вторичная периодичность
s- и р-элементы
Выше рассмотрены общие тенденции в характере изменения значений энергии ионизации атомов, энергии сродства атомов к электрону, электроотрицательности, атомных и ионных радиусов, энергии атомизации простых веществ, степени окисления, окислительных потенциалов простых веществ от атомного номера элемента. При более глубоком изучении этих тенденций можно обнаружить, что закономерности в изменении свойств элементов в периодах и группах значительно сложнее. В характере изменения свойств элементов по периоду проявляется внутренняя периодичность, а по группе — вторичная периодичность (открыта Е. В. Бироном в 1915 году).
Так, при переходе от s-элемента I группы к р-элементу VIII группы на кривой энергии ионизации атомов и кривой изменения их радиусов имеются внутренние максимумы и минимумы[25] (см. рис. 1, 2, 4).
Это свидетельствует о внутреннепериодическом характере изменения этих свойств по периоду. Объяснение отмеченных закономерностей можно дать с помощью представления об экранировании ядра.
Эффект экранирования ядра обусловлен электронами внутренних слоёв, которые, заслоняя ядро, ослабляют притяжение к нему внешнего электрона. Так, при переходе от бериллия 4Be к бору 5B, несмотря на увеличение заряда ядра, энергия ионизации атомов уменьшается:

Это объясняется тем, что притяжение к ядру 2р-электрона атома бора ослаблено за счёт экранирующего действия 2s-электронов.
Понятно, что экранирование ядра возрастает с увеличением числа внутренних электронных слоёв. Поэтому в подгруппах s- и р-элементов наблюдается тенденция к уменьшению энергии ионизации атомов (см. рис. 1).
Уменьшение энергии ионизации от азота 7N к кислороду 8О (см. рис. 1) объясняется взаимным отталкиванием двух электронов одной и той же орбитали:

Эффектом экранирования и взаимного отталкивания электронов одной орбитали объясняется также внутреннепериодический характер изменения по периоду атомных радиусов (см. рис. 4).

В характере изменения свойств s- и р-элементов в подгруппах отчётливо наблюдается вторичная периодичность (рис. 7). Для её объяснения привлекается представление о проникновении электронов к ядру. Как показано на рисунке 9, электрон любой орбитали определённое время находится в области, близкой к ядру. Иными словами, внешние электроны проникают к ядру через слои внутренних электронов. Как видно из рисунка 9, внешний 3s-электрон атома натрия обладает весьма значительной вероятностью находиться вблизи ядра в области внутренних К- и L-электронных слоёв.
Концентрация электронной плотности (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s-электрона, меньше — для р-электрона, ещё меньше — для d-электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3s>3p>3d (см. рис. 10).
Понятно, что эффект проникновения увеличивает прочность связи внешних электронов с ядром. Вследствие более глубокого проникновения s-электроны в большей степени экранируют ядро, чем р-электроны, а последние — сильнее, чем d-электроны, и т. д.
Пользуясь представлением о проникновении электронов к ядру, рассмотрим характер изменения радиуса атомов элементов в подгруппе углерода. В ряду C—Si—Ge—Sn—Pb проявляется общая тенденция увеличения радиуса атома (см. рис. 4, 7). Однако это увеличение имеет немонотонный характер. При переходе от Si к Ge внешние р-электроны проникают через экран из десяти 3d-электронов и тем самым упрочняют связь с ядром и сжимают электронную оболочку атома. Уменьшение размера 6p-орбитали Pb по сравнению с 5р-орбиталью Sn обусловлено проникновением 6p-электронов под двойной экран десяти 5d-электронов и четырнадцати 4f-электронов. Этим же объясняется немонотонность в изменении энергии ионизации атомов в ряду C—Pb и большее значение её для Pb по сравнению с атомом Sn (см. рис. 1).
d-Элементы
Во внешнем слое у атомов d-элементов (за исключением Pd) находятся 1—2 электрона (ns-состояние). Остальные валентные электроны расположены в (n—1)d-состоянии, то есть в предвнешнем слое.
Подобное строение электронных оболочек атомов определяет некоторые общие свойства d-элементов[26]. Так, их атомы характеризуются сравнительно невысокими значениями первой энергии ионизации. Как видно на рисунке 1, при этом характер изменения энергии ионизации атомов по периоду в ряду d-элементов более плавный, чем в ряду s- и p-элементов. При переходе от d-элемента III группы к d-элементу II группы значения энергии ионизации изменяются немонотонно. Так, на участке кривой (рис. 1) видны две площадки, соответствующие энергии ионизации атомов, в которых заполняются Зd-орбитали по одному и по два электрона. Заполнение 3d-орбиталей по одному электрону заканчивается у Mn (3d54s2), что отмечается некоторым повышением относительной устойчивости 4s2-конфигурации за счёт проникновения 4s2-электронов под экран 3d5-конфигурации. Наибольшее значение энергии ионизации имеет Zn (3d104s2), что находится в соответствии с полным завершением Зd-подслоя и стабилизацией электронной пары за счёт проникновения под экран 3d10-конфигурации.
В подгруппах d-элементов значения энергии ионизации атомов в общем увеличиваются. Это можно объяснить эффектом проникновения электронов к ядру. Так, если у d-элементов 4-го периода внешние 4s-электроны проникают под экран 3d-электронов, то у элементов 6-го периода внешние 6s-электроны проникают уже под двойной экран 5d- и 4f-электронов. Например:
| 22Ti …3d24s2 | I = 6,82 эВ |
| 40Zr …3d104s24p64d25s2 | I = 6,84 эВ |
| 72Hf… 4d104f145s25p65d26s2 | I = 7,5 эВ |
Поэтому у d-элементов 6-го периода внешние бs-электроны связаны с ядром более прочно и, следовательно, энергия ионизации атомов больше, чем у d-элементов 4-го периода.
Размеры атомов d-элементов являются промежуточными между размерами атомов s- и p-элементов данного периода. Изменение радиусов их атомов по периоду более плавное, чем для s- и p-элементов.
В подгруппах d-элементов радиусы атомов в общем увеличиваются. Важно отметить следующую особенность: увеличение атомных и ионных радиусов в подгруппах d-элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы атомов d-элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счёт возрастания числа электронных слоёв при переходе от 5-го к 6-му периоду компенсируется f-сжатием, вызванным заполнением электронами 4f-подслоя у f-элементов 6-го периода. В этом случае f-сжатие называется лантаноидным. При аналогичных электронных конфигурациях внешних слоёв и примерно одинаковых размерах атомов и ионов для d-элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Отмеченным закономерностям не подчиняются элементы подгруппы скандия. Для этой подгруппы типичны закономерности, характерные для соседних подгрупп s-элементов.
Периодический закон — основа химической систематики
См. также
- Периодичность
- Список химических элементов по атомным номерам
- Хронология открытия химических элементов
- Блок периодической таблицы
Примечания
- ↑ 1 2 Менделеев Д. И. Периодический закон. — М.: Издательство Академии наук СССР, 1958. — С. 111. — (Классики науки). — 7000 экз.
- ↑ В книге В. М. Потапов, Г. Н. Хомченко «Химия», М. 1982 (стр. 26) утверждается, что их более 400.
- ↑ Иоганн-Вольфганг ДЁБЕРЕЙНЕР. Дата обращения: 12 мая 2009. Архивировано 15 октября 2008 года.
- ↑ Краткий очерк истории химии. Дата обращения: 12 мая 2009. Архивировано 31 мая 2009 года.
- ↑ Периодическая система элементов
- ↑ Первые попытки систематизации элементов. Дата обращения: 12 мая 2009. Архивировано 6 февраля 2009 года.
- ↑ Периодическая система элементов / Д. Н. Трифонов // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1975. — Т. 19 : Отоми — Пластырь. — С. 413—417. — 630 000 экз.
- ↑ Трифонов Д. Н. Несостоявшееся выступление Менделеева (6 (18) марта 1869 г.) Архивная копия от 18 марта 2014 на Wayback Machine // Химия, № 04 (699), 16-28.02.2006
- ↑ Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- ↑ Менделеев, Д. Соотношение свойств с атомным весом элементов // Журнал Русского Химического Общества (Journal of the Russian Chemical Society) : журнал. — 1869. — Т. 1. — С. 60—77. Архивировано 27 февраля 2021 года.
- ↑ Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- ↑ Mendeleev, Dmitri. Versuche eines Systems der Elemente nach ihren Atomgewichten und chemischen Functionen (нем.) // Journal für Praktische Chemie : magazin. — 1869. — Bd. 106. — S. 251.
- ↑ Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества. — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- ↑ Периодический закон химических элементов // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 185. — ISBN 5-7155-0292-6.
- ↑ D. Mendelejeff. Die periodische Gesetzmässigkeit der Elemente (нем.) // Annalen der Chemie und Pharmacie : magazin. — 1872. — Bd. VIII. Supplementbandes zweites Heft. — S. 144. Архивировано 4 марта 2021 года.
- ↑ Вильям Рамзай. Биография (англ.). Дата обращения: 12 мая 2009. Архивировано 7 января 2010 года.
- ↑ Периодическое изменение свойств химических элементов. Дата обращения: 12 мая 2009. Архивировано 11 февраля 2009 года.
- ↑ Многоэлектронные атомы. Дата обращения: 12 мая 2009. Архивировано из оригинала 4 июня 2009 года.
- ↑ Особенности электронного строения атомов хрома, меди и некоторых других элементов. Дата обращения: 12 мая 2009. Архивировано 21 февраля 2009 года.
- ↑ Интерметаллиды. Дата обращения: 12 мая 2009. Архивировано 10 ноября 2014 года.
- ↑ Атомная физика. Дата обращения: 12 мая 2009. Архивировано 3 марта 2009 года.
- ↑ Основные понятия и законы химии. Дата обращения: 12 мая 2009. Архивировано из оригинала 4 мая 2009 года.
- ↑ Периодическая система химических элементов. Дата обращения: 12 мая 2009. Архивировано 10 ноября 2014 года.
- ↑ Химия. Дата обращения: 12 мая 2009. Архивировано из оригинала 17 апреля 2009 года.
- ↑ Периодический закон Д. И. Менделеева. Дата обращения: 6 мая 2009. Архивировано из оригинала 16 февраля 2009 года.
- ↑ d-Элементы. Дата обращения: 12 мая 2009. Архивировано 26 июня 2006 года.
Литература
- Ахметов Н. С. Актуальные вопросы курса неорганической химии. — М.: Просвещение, 1991. — 224 с — ISBN 5-09-002630-0
- Дружинин П.А. Загадка «Таблицы Менделеева»: История публикации открытия Д.И. Менделеевым Периодического закона. — Москва: Новое Литературное Обозрение, 2019. — 164 с. — ISBN 978-5-4448-0976-1.
- Корольков Д. В. Основы неорганической химии. — М.: Просвещение, 1982. — 271 с.
- Менделеев Д. И. Основы химии, т. 2. М.: Госхимиздат, 1947. 389 c.
- Менделеев Д.И. Периодическая законность химических элементов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки
- Менделеев Д. И. Периодический закон: В 3 т. на сайте Руниверс
- Периодический закон Д. И. Менделеева
- Периодический закон Менделеева и периодическая система элементов
- Периодический закон Менделеева
- Закон Менделеева — закон природы
- Периодический закон Менделеева в свете синергетической теории информации
