Holangiokarcinom
| Holangiokarcinom | |
|---|---|
| Sopomenke | rak žolčnih vodov[1] |
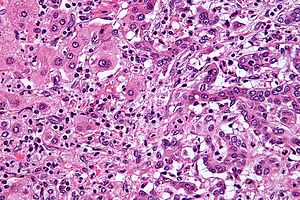 | |
| Mikroskopski prikaz celic intrahepatičnega holangiokarcinoma (na desni strani) v primerjavi z zdravimi jetrnimi celicami (na levi strani) (barvanje HE). | |
| Specialnost | onkologija |
| Simptomi | bolečina v trebuhu, zlatenica, hujšanje, generaliziran srbež, vročina[2] |
| Običajni začetek | starost 70 let in več[3] |
| Tipi | intrahepatični, perihilarni, distalni[3] |
| Dejavniki tveganja | primarni sklerozirajoči holangitis, ulcerozni kolitis, okužba žolčnih vodov z zajedavci, nekatere prirojene jetrne nepravilnosti[2][1] |
| Diagnostični postopki | potrditev diagnoze histološkim pregledom vzorca tkiva pod mikroskopom[4] |
| Zdravljenje | kirurška resekcija, kemoterapija, obsevanje, vstavitev opornic v žolčne vode, presaditev jeter[2][1] |
| Prognoza | načeloma slaba[5] |
| Pogostost | 1–2 primera na 100.000 prebivalcev na leto (zahodni svet)[6] |
Holángiokarcinóm ali rak žolčnih vodov je rak (praviloma adenokarcinom oziroma rak žleznega tkiva), ki vznikne iz celic epitelija žolčnih izvodil.[7][8][9] Možni simptomi zajemajo bolečino v trebuhu, zlatenico, hujšanje, generaliziran srbež in vročino.[2] Lahko se pojavita tudi svetlo obarvano blato in/ali temno obarvan seč.[4] Gre za obliko raka žolčnega sistema, kamor spadata še rak žolčnika in rak hepatopankreatične ampule.[10]
Dejavniki tveganja za razvoj holangiokarcinoma so primarni sklerozirajoči holangitis (vrsta vnetne bolezni žolčnih izvodil), ulcerozni kolitis, ciroza jeter, hepatitis C, hepatitis B, okužba žolčevodov z zajedavci in nekatere prirojene jetrne nepravilnosti.[2][1][3][11] Pri večini bolnikov ni prepoznanih dejavnikov tveganja.[3] Na diagnozo holangiokarcinoma se posumi na osnovi kombinacije več preiskav, in sicer krvnih testov, slikovnih metod, endoskopije in včasih kirurške preiskave.[4] Potrditev diagnoze temelji na mikroskopskem pregledu biopsijskega vzorca tumorja.[4]
Za ozdravitev je pomembna zgodnja prepoznava bolezni, ko je še možna kirurška odstranitev rakavega tkiva v celoti. Radikalno operativno zdravljenje z negativnimi histološkim robovi je edino zdravljenje holangiokarcinomov, ki omogoča dolgoročno preživetje, vendar je ob diagnozi holangiokarcinom običajno že razširjen in neozdravljiv.[12][2][13] V teh primerih preostane možnost paliativnega zdravljenja, ki lahko vključuje kirurško resekcijo, kemoterapijo, zdravljenje tarčnimi zdravili, imunoterapijo, obsevanje in vstavitev opornic v žolčne vode.[2][1][2][14] Pri okoli tretjini bolnikov, pri katerih je holangiokarcinom omejen na skupni žolčevod, ter redkeje v primeru, da rak zajema druge strukture, je možno tumor v celoti kirurško odstraniti, kar predstavlja možnost ozdravitve.[2] Četudi je kirurška odstranitev tumorja možna in uspešna, se praviloma priporoča se še zdravljenje s kemoterapijo in obsevanjem.[2] V nekaterih primerih pride v poštev presaditev jeter.[3] Tudi če je operativni poseg uspešen, je petletno preživetje ponavadi manj kot 50-odstotno.[6]
V zahodnem svetu je holangiokarcinom redek in se po ocenah pojavi pri 0,5–2 posameznikih na 100.000 prebivalcev na leto.[2][6] Pojavnost je večja v jugovzhodni Aziji, kjer so pogoste okužbe žolčnega sistema s paraziti.[5] V predelih Tajske je pojavnost 60 primerov na 100.000 prebivalcev na leto.[5] Ponavadi se pojavi pri posameznikih v osmem desetletju življenja; pri bolnikih s primarnim sklerozirajočim holangitisom pa že v petem desetletju življenja.[3] Pojavnost znotrajjetrnega holangiokarcinoma se v zahodnem svetu povečuje.[6]
Znaki in simptomi
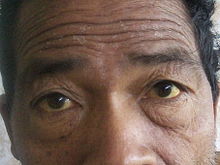
Simptomi raka žolčnih vodov so neznačilni in se pojavljajo tudi pri drugih boleznih jeter in žolčevodov.[1][14] Običajno se simptomi pojavijo šele pri napredovali bolezni.[9] Najpogostejši znaki in simptomi, ki kažejo na bolezen, so nenormalni izvidi testov jetrne funkcije, zlatenica (porumenelost kože in beločnic zaradi blokade žolčnih vodov), bolečina v trebuhu (30–50 %), generaliziran srbež (66 %), hujšanje (30–50 %), vročina (do 20 %) in spremenjena obarvanost blata ali seča.[15] Do neke mere je lahko simptomatika tudi odvisna od lokacije tumorja; bolniki z zunajjetrnim hokangiokarcinomom (ki prizadene žolčne vode zunaj jeter) imajo večjo verjetnost za pojav zlatenice, medtem ko je pri znotrajjetrnem holangiokarcinomu bolj verjetna prisotnost bolečine brez spremljajoče zlatenice.[16]
Krvni testi za ugotavljanje delovanja jeter pogosto pokažejo na obstrukcijo žolčnih vodov, s povišanimi vrednostmi bilirubina, alkalne fosfataze in γ-glutamiltransferaze ter relativno normalnimi vrednostmi transaminaz. To kaže, da je primarni vzrok zlatenice obstrukcija žolčnih vodov in ne vnetje ali okužba jetrnega parenhima.[17]
Dejavniki tveganja
Čeprav pri večini bolnikov ni prepoznanih nobenih obstoječih bolezni ali stanj, ki bi jim lahko priposali povečanje tveganja za razvoj holangiokarcinoma,[3], pa obstaja več dejavnikov tveganja, za katere je znano, da lahko prispevajo k razvoju bolezni. V zahodnem svetu je najpogostejši dejavnik tveganja primarni sklerozirajoči holangitis (PSC), vnetna bolezen žolčnih vodov, ki je povezana s prisotnostjo ulceroznega kolitisa.[18] Epidemiologiške raziskave kažejo, da imajo bolniki s PSC 10- do 15-odstotno tveganje za razvoj holangiokarcinoma tekom življenja.[19] V raziskavah, v katerih so preučevali avtopsijske vzorce bolnikov s PSC, so ugotovili celo večje tveganje, in sicer do 30-odstotno.[20] Pri bolnikih z vnetno črevesno boleznijo, pri katerih je prisotna okrnjena funkcija popravljanja DNK, je progresija PSC v holangiokarcinom morda povezana s poškodbami DNK zaradi prisotnega vnetja in kopičenja žolčnih kislin.[21]
Tveganje za nastanek holangiokarcinoma lahko povečajo tudi okužbe jeter z določenimi zajedavci. Ugotovili so, da lahko tveganje za holangiokarcinom poveča na primer okužba z jetrnima metljajema Opisthorchis viverrini (pojavlja se na Tajskem, v Laosu in Vietnamu)[22][23][24] in Clonorchis sinensis (pojavlja se na Kitajskem, Tajvanu, v vzhodni Rusiji, Koreji in Vietnamu).[25] V nekaterih državah so s programi osveščanja o ustrezni toplotni obdelavi hrane uspešno zmanjšali razširjenost teh okužb in s tem pojavnost holangiokarcinoma.[26] Tudi bolniki z drugimi kroničnimi jetrnimi boleznimi, kot so hepatitis B, hepatitis C,[27][28][29] alkoholna jetrna bolezen in jetrna ciroza zaradi drugih vzrokov, imajo povečano tveganje za pojav holangiokarcinoma.[30][31] V eni od raziskav so ugotovili, da je tudi okužba s hivom povezana s povečanim tveganjem za pojav holangiokarcinoma, vendar raziskovalci niso uspeli ugotoviti, ali je tveganje povečano zaradi same okužbe s hivom ali zaradi drugih dejavnikov pri preučevani populaciji (na primer sookužbe s hepatitisom C).[30]
Bakterijska okužba s Helicobacter bilis ali Helicobacter hepaticus lahko poveča tveganje za vznik raka žolčnega sistema.[32]
Pri določenih prirojenih jetrnih boleznih, kot je Carolijeva bolezen (prirojene razširitve znotrajjetrnih žolčnih vodov z jetrno fibrozo), so prav tako ugotovili povečano tveganje za holangiokarcinom; pri Carolijevi bolezni je tveganje za pojav holangiokarcinoma tekom življenja okoli 15-odstotno.[33][34] Redki dedni bolezni Lynchov sindrom II in biliarna papilomatoza sta prav tako povezani s povečanim tveganjem za holangiokarcinom.[35][36] Za žolčne kamne ni jasnih podatkov, ki bi kazali na povečano tveganje, obstaja pa močna povezava med znotrajjetrnimi kamni (ki so v zahodnem svetu redki, pogosteje pa se pojavljajo v predelih Azije) in pojavnostjo holangiokarcinoma.[37][38][39] Večjo pojavnost holangiokarcinoma so ugotovili pri ljudeh, ki so bili izpostavljeni torotrastu, obliki totijevega oksida, ki so ga uporabljali kot kontrastno sredstvo v radiologiji. Primeri holangiokarcinoma so se pojavljali tudi po 30–40 po izpostavljenosti torotrastu. Zaradi rakotvornosti so uporabo torotrasta v 50-ih prejšnjega stoletja v ZDA prepovedali.[40][41][42]
Patofiziologija
Holangiokarcinom lahko vznikne kjerkoli v žolčnih vodih, in sicer bodisi v predelu znotraj bodisi zunaj jeter. Če se rak pojavi v žolčnih vodih, ki se nahajajo znotraj jeter, govorimo o znotrajjetrnem (intrahepatičnem) holangikarcinomu, če pa rak vznikne v predelu zunaj jeter, pa o zunajjetrnem (ekstrahepatičnem) holangiokarcinomu. Rak v predelu žolčnih vodov, kjer izstopajo iz jeter, se imenuje perihilarni holangiokarcinom. Zunajjetrni holangiokarcinom v predelu stekališča levega in desnega jetrnega voda v skupni jetrni vod se imenuje Klatskinov tumor.[43]
Čeprav v večini primerov celice holangiokarcinoma izražajo histološke in molekularne značilnosti adenokarcinoma epitelnih celic, ki obdajajo žolčna izvodila, pravi izvor rakavih celic ni pojasnjen. Novejši podatki nakazujejo, da začetne spremenjene celice, iz katerih se razvije primarni tumor, morda izvirajo iz pluripotentnih jetrnih matičnih celic.[44][45][46] Razvoj holangiokarcinoma poteka po več stopnjah: od zgodnje hiperplazije in metaplazije, preko displazije do razvoja pravega raka; proces je podoben kot pri nastanku raka debelega črevesa.[47] V tem procesu odigrajo pomembno vlogo kronično vnetje in obstrukcija žolčnih izvodil ter posledično moteno odtekanje žolča.[47][48][49]
Zdravljenje
Če ni možna popolna kirurška odstranitev vseh prisotnih tumorjev, velja holangiokarcinom za neozdravljivo bolezen z relativno hitrim napredovanjem do smrtnega izida. Primernost bolnikovega stanja za uspešno kirurško odstranitev raka se lahko v večini primerov oceni šele z operacijo,[50] zato se pri večini bolnikov opravi eksploracijska operacija, razen če obstajajo že pred kirurškim posegom jasne indikacije, da je tumor neoperabilen.[17] Leta 2008 so na Kliniki Mayo poročali o znatnih uspehih zdravljenja zgodnjega holangiokarcinoma s presaditvijo jeter, ob upoštevanju ustreznega protokola in strogih meril.[51]
Pri nekaterih bolnikih, ki niso kandidati za kirurško odstranitev tumorja oziroma tumorjev, lahko pride v poštev dopolnilna (adjuvantna) kemoterapija, ki ji nato sledi presaditev jeter.[52] Pri bolnikih z neoperabilnim znotrajjetrnim holangiokarcinomom lahko za ozdravitev ali kot paliativne oblike zdravljenja pridejo v poštev lokoregionalne terapije, kot so transarterijska kemoembolizacija (TACE), transarterijska radioembolizacija (TARE) in ablacijske terapije.[53]
Ob postavitvi diagnoze ima večina bolnikov napredovalo obliko bolezni in so zato kandidati le za nekirurško zdravljenje.[13]
Dopolnilna kemoterapija in obsevanje
Pri bolnikih, pri katerih je bil tumor uspešno kirurško odstranjen, se lahko za zvečanje uspešnosti zdravljenja oziroma zmanjšanja tveganja za ponovitev bolezni nato uvede še dopolnilna kemoterapija ali obsevanje. Če so robovi izrezanega (eksciziranega) tkiva negativni, kar kaže na to, da je bil tumor povsem izrezan, koristi dopolnilne kemoterapije niso potrjene oziroma nekateri podatki kažejo, da takšno zdravljenje ne izboljša izidov.[54][55] Zdravljenje bolnikov z negativnimi robovi tkiva z obsevanjem je v raziskavah pokazalo tako pozitivne[56][57] kot negativne[16][58][59] rezultate.
Če so robovi eksciziranega tkiva pozitivni, kar kaže na nepopolno kirurško odstranitev tumorja, se glede na podatke, ki so na razpolago, priporoča dopolnilno zdravljenje z obsevanjem, v poštev pa pride tudi kemoterapija.[60][61]
Zdravljenje napredovale bolezni
V večini primerov je pri bolnikih bolezen ob diagnozi že napredovala in kirurška odstranitev tumorja ni možna.[62] Pri bolnikih z napredovalim rakom žolčnih vodov, ki so v primerno dobrem siceršnjem zdravstvenem stanju, se priporoča sistemsko zdravljenje.[63] Osnova sistemskega paliativnega zdravljenja napredovale bolezni ostaja kemoterapija (v Sloveniji zlasti na osnovi cisplatina in gemcitabina), v novejšem času pa se za povečanje učinkovitosti s kemoterapijo uporablja še imunoterapija. Če so v tumorskih celicah prisotne določene mutacije genov, se lahko uporabijo tudi novejša tarčna zdravila.[63][14]
Kemoterapija je pri bolnikih z napredovalim neoperabilnim rakom žolčnih vodov v randomiziranem kliničnem preskušanju izkazala izboljšanje kakovosti življenja in podaljšanje preživetja.[64] Uporabljajo se različni citostatiki oziroma njihove kombinacije, na primer 5-fluorouracil in levkovorin,[65] gemcitabin kot samostojno zdravilo[66] ali v kombinaciji s cisplatinom,[67] irinotekan[68] ali kapecitabin.[69]
Za zdravljenje napredovalega raka žolčnih vodov se v kombinaciji s kemoterapijo v zadnjem času uporablja tudi imunoterapija, in sicer zdravilo durvalumab iz skupine zaviralcev imunskih nadzornih točk. Primerna je za bolnike, ki so v dovolj dobrem splošnem stanju.[14]
Sklici
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 https://www.onko-i.si/o-raku/vrste-raka/rak-zolcnega-sistema , Onkološki inštitut Ljubljana, vpogled: 11. 1. 2025.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 »Bile Duct Cancer (Cholangiocarcinoma) Treatment«. National Cancer Institute. 23. september 2020. Pridobljeno 29. maja 2021.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 Razumilava N, Gores GJ (Junij 2014). »Cholangiocarcinoma«. Lancet. 383 (9935): 2168–2179. doi:10.1016/S0140-6736(13)61903-0. PMC 4069226. PMID 24581682.
- ↑ 4,0 4,1 4,2 4,3 »Bile Duct Cancer (Cholangiocarcinoma)«. National Cancer Institute. 5. julij 2018. Pridobljeno 21. januarja 2019.
- ↑ 5,0 5,1 5,2 Bosman, Frank T. (2014). »Chapter 5.6: Liver cancer«. V Stewart, Bernard W.; Wild, Christopher P (ur.). World Cancer Report (PDF). the International Agency for Research on Cancer, World Health Organization. str. 403–12. ISBN 978-92-832-0443-5.

- ↑ 6,0 6,1 6,2 6,3 Bridgewater JA, Goodman KA, Kalyan A, Mulcahy MF (2016). »Biliary Tract Cancer: Epidemiology, Radiotherapy, and Molecular Profiling«. American Society of Clinical Oncology Educational Book. American Society of Clinical Oncology. Annual Meeting. 35 (36): e194-203. doi:10.1200/EDBK_160831. PMID 27249723.
- ↑ https://www.termania.net/slovarji/slovenski-medicinski-slovar/5519250/holangiokarcinom?query=holangiokarcinom&SearchIn=All, Slovenski medicinski e-slovar, vpohled: 11. 1. 2025.
- ↑ »cholangiocarcinoma«. National Cancer Institute. 2. februar 2011. Pridobljeno 21. januarja 2019.
- ↑ 9,0 9,1 Strojan, Primož; Hočevar, Marko; Rudolf, Zvonimir; Gorišek, Borut (18. april 2018). Onkologija: Učbenik za študente medicine. Onkološki inštitut Ljubljana. doi:10.25670/oi2018-001m.[mrtva povezava]
- ↑ Benavides M, Antón A, Gallego J, Gómez MA, Jiménez-Gordo A, La Casta A, in sod. (december 2015). »Biliary tract cancers: SEOM clinical guidelines«. Clinical & Translational Oncology. 17 (12): 982–7. doi:10.1007/s12094-015-1436-2. PMC 4689747. PMID 26607930.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Steele JA, Richter CH, Echaubard P, Saenna P, Stout V, Sithithaworn P, in sod. (Maj 2018). »Thinking beyond Opisthorchis viverrini for risk of cholangiocarcinoma in the lower Mekong region: a systematic review and meta-analysis«. Infectious Diseases of Poverty. 7 (1): 44. doi:10.1186/s40249-018-0434-3. PMC 5956617. PMID 29769113.
- ↑ Zhang, Tan; Zhang, Sina; Jin, Chen; in sod. (2021). »A Predictive Model Based on the Gut Microbiota Improves the Diagnostic Effect in Patients with Cholangiocarcinoma«. Frontiers in Cellular and Infection Microbiology. 11: 751795. doi:10.3389/fcimb.2021.751795. PMC 8650695. PMID 34888258.
- ↑ 13,0 13,1 Meden Boltežar, Anja, Šečerov Ermenc, Ajra (2021). Zdravljenje intrahepatalnega holangiokarcinoma s stereotaktičnim obsevanjem. Onkologija (Ljubljana), letnik 25, številka 1, str. 68-71.
- ↑ 14,0 14,1 14,2 14,3 »Rak žolčnika in žolčevodov« (PDF). Združenje EuropaColon Slovenija. 2024. Pridobljeno 11. januarja 2025.[mrtva povezava]
- ↑ Nagorney DM, Donohue JH, Farnell MB, Schleck CD, Ilstrup DM (Avgust 1993). »Outcomes after curative resections of cholangiocarcinoma«. Archives of Surgery. 128 (8): 871–7, discussion 877–9. doi:10.1001/archsurg.1993.01420200045008. PMID 8393652.
- ↑ 16,0 16,1 Nakeeb A, Pitt HA, Sohn TA, Coleman J, Abrams RA, Piantadosi S, in sod. (Oktober 1996). »Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors«. Annals of Surgery. 224 (4): 463–473, discussion 473–5. doi:10.1097/00000658-199610000-00005. PMC 1235406. PMID 8857851.
- ↑ 17,0 17,1 Mark Feldman; Lawrence S. Friedman; Lawrence J. Brandt, ur. (21. julij 2006). Sleisenger and Fordtran's Gastrointestinal and Liver Disease (8th izd.). Saunders. str. 1493–6. ISBN 978-1-4160-0245-1.
- ↑ Chapman RW (1999). »Risk factors for biliary tract carcinogenesis«. Annals of Oncology. 10 (Suppl 4): 308–311. doi:10.1023/A:1008313809752. PMID 10436847.
- ↑ Epidemiološke raziskave, v katerih so preučevali pojavnost holangiokarcinoma pri bolnikih s PSC, so med drugim:
- Bergquist A, Ekbom A, Olsson R, Kornfeldt D, Lööf L, Danielsson A, in sod. (Marec 2002). »Hepatic and extrahepatic malignancies in primary sclerosing cholangitis«. Journal of Hepatology. 36 (3): 321–327. doi:10.1016/S0168-8278(01)00288-4. PMID 11867174.
- Bergquist A, Glaumann H, Persson B, Broomé U (Februar 1998). »Risk factors and clinical presentation of hepatobiliary carcinoma in patients with primary sclerosing cholangitis: a case-control study«. Hepatology. 27 (2): 311–316. doi:10.1002/hep.510270201. PMID 9462625.
- Burak K, Angulo P, Pasha TM, Egan K, Petz J, Lindor KD (Marec 2004). »Incidence and risk factors for cholangiocarcinoma in primary sclerosing cholangitis«. American Journal of Gastroenterology. 99 (3): 523–526. doi:10.1111/j.1572-0241.2004.04067.x. PMID 15056096. S2CID 8412954.
- ↑ Napaka navajanja: Značke
<ref>z imenomautopsyne morete predogledati, ker je opredeljena zunaj trenutnega razdelka ali sploh ni opredeljena. - ↑ Labib, Peter L.; Goodchild, George; Pereira, Stephen P. (2019). »Molecular Pathogenesis of Cholangiocarcinoma«. BMC Cancer. 19 (1): 185. doi:10.1186/s12885-019-5391-0. PMC 6394015. PMID 30819129.
- ↑ Watanapa P, Watanapa WB (Avgust 2002). »Liver fluke-associated cholangiocarcinoma«. British Journal of Surgery. 89 (8): 962–70. doi:10.1046/j.1365-2168.2002.02143.x. PMID 12153620. S2CID 5606131.
- ↑ Sripa B, Kaewkes S, Sithithaworn P, Mairiang E, Laha T, Smout M, in sod. (Julij 2007). »Liver fluke induces cholangiocarcinoma«. PLOS Medicine. 4 (7): e201. doi:10.1371/journal.pmed.0040201. PMC 1913093. PMID 17622191.
- ↑ Sripa B, Kaewkes S, Intapan PM, Maleewong W, Brindley PJ (2010). Food-borne trematodiases in Southeast Asia epidemiology, pathology, clinical manifestation and control. Advances in Parasitology. Zv. 72. str. 305–350. doi:10.1016/S0065-308X(10)72011-X. ISBN 9780123815132. PMID 20624536.
- ↑ Rustagi T, Dasanu CA (Junij 2012). »Risk factors for gallbladder cancer and cholangiocarcinoma: similarities, differences and updates«. Journal of Gastrointestinal Cancer. 43 (2): 137–47. doi:10.1007/s12029-011-9284-y. PMID 21597894. S2CID 31590872.
- ↑ Sripa B, Tangkawattana S, Sangnikul T (Avgust 2017). »The Lawa model: A sustainable, integrated opisthorchiasis control program using the EcoHealth approach in the Lawa Lake region of Thailand«. Parasitology International. 66 (4): 346–354. doi:10.1016/j.parint.2016.11.013. PMC 5443708. PMID 27890720.
- ↑ Kobayashi M, Ikeda K, Saitoh S, Suzuki F, Tsubota A, Suzuki Y, in sod. (Junij 2000). »Incidence of primary cholangiocellular carcinoma of the liver in Japanese patients with hepatitis C virus-related cirrhosis«. Cancer. 88 (11): 2471–7. doi:10.1002/1097-0142(20000601)88:11<2471::AID-CNCR7>3.0.CO;2-T. PMID 10861422. S2CID 22206944.
- ↑ Yamamoto S, Kubo S, Hai S, Uenishi T, Yamamoto T, Shuto T, in sod. (Julij 2004). »Hepatitis C virus infection as a likely etiology of intrahepatic cholangiocarcinoma«. Cancer Science. 95 (7): 592–5. doi:10.1111/j.1349-7006.2004.tb02492.x. PMC 11158843. PMID 15245596.
{navedi časopis}: Preveri|pmc=vrednost (pomoč) - ↑ Lu H, Ye MQ, Thung SN, Dash S, Gerber MA (december 2000). »Detection of hepatitis C virus RNA sequences in cholangiocarcinomas in Chinese and American patients«. Chinese Medical Journal. 113 (12): 1138–41. PMID 11776153.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ 30,0 30,1 Napaka navajanja: Značke
<ref>z imenomriskfactorsne morete predogledati, ker je opredeljena zunaj trenutnega razdelka ali sploh ni opredeljena. - ↑ Sorensen HT, Friis S, Olsen JH, Thulstrup AM, Mellemkjaer L, Linet M, in sod. (Oktober 1998). »Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark«. Hepatology. 28 (4): 921–5. doi:10.1002/hep.510280404. PMID 9755226. S2CID 72842845.
- ↑ Chang AH, Parsonnet J (Oktober 2010). »Role of bacteria in oncogenesis«. Clinical Microbiology Reviews. 23 (4): 837–857. doi:10.1128/CMR.00012-10. PMC 2952975. PMID 20930075.
- ↑ Lipsett PA, Pitt HA, Colombani PM, Boitnott JK, Cameron JL (november 1994). »Choledochal cyst disease. A changing pattern of presentation«. Annals of Surgery. 220 (5): 644–52. doi:10.1097/00000658-199411000-00007. PMC 1234452. PMID 7979612.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Dayton MT, Longmire WP, Tompkins RK (Januar 1983). »Caroli's Disease: a premalignant condition?«. American Journal of Surgery. 145 (1): 41–8. doi:10.1016/0002-9610(83)90164-2. PMID 6295196.
- ↑ Mecklin JP, Järvinen HJ, Virolainen M (Marec 1992). »The association between cholangiocarcinoma and hereditary nonpolyposis colorectal carcinoma«. Cancer. 69 (5): 1112–4. doi:10.1002/cncr.2820690508. PMID 1310886. S2CID 23468163.
- ↑ Lee SS, Kim MH, Lee SK, Jang SJ, Song MH, Kim KP, in sod. (Februar 2004). »Clinicopathologic review of 58 patients with biliary papillomatosis«. Cancer. 100 (4): 783–93. doi:10.1002/cncr.20031. PMID 14770435.
- ↑ Lee CC, Wu CY, Chen GH (september 2002). »What is the impact of coexistence of hepatolithiasis on cholangiocarcinoma?«. Journal of Gastroenterology and Hepatology. 17 (9): 1015–1020. doi:10.1046/j.1440-1746.2002.02779.x. PMID 12167124. S2CID 25753564.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Su CH, Shyr YM, Lui WY, P'Eng FK (Julij 1997). »Hepatolithiasis associated with cholangiocarcinoma«. British Journal of Surgery. 84 (7): 969–973. doi:10.1002/bjs.1800840717. PMID 9240138. S2CID 29475282.
- ↑ Donato F, Gelatti U, Tagger A, Favret M, Ribero ML, Callea F, in sod. (december 2001). »Intrahepatic cholangiocarcinoma and hepatitis C and B virus infection, alcohol intake, and hepatolithiasis: a case-control study in Italy«. Cancer Causes & Control. 12 (10): 959–64. doi:10.1023/A:1013747228572. PMID 11808716. S2CID 12117363.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Sahani D, Prasad SR, Tannabe KK, Hahn PF, Mueller PR, Saini S (2003). »Thorotrast-induced cholangiocarcinoma: case report«. Abdominal Imaging. 28 (1): 72–74. doi:10.1007/s00261-001-0148-y. PMID 12483389. S2CID 23531547.
- ↑ Zhu AX, Lauwers GY, Tanabe KK (2004). »Cholangiocarcinoma in association with Thorotrast exposure«. Journal of Hepato-Biliary-Pancreatic Surgery. 11 (6): 430–3. doi:10.1007/s00534-004-0924-5. PMID 15619021.
- ↑ Lipshutz GS, Brennan TV, Warren RS (november 2002). »Thorotrast-induced liver neoplasia: a collective review«. Journal of the American College of Surgeons. 195 (5): 713–718. doi:10.1016/S1072-7515(02)01287-5. PMID 12437262.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Klatskin G (Februar 1965). »Adenocarcinoma of the Hepatic Duct at Its Bifurcation Within The Porta Hepatis. An Unusual Tumor With Distinctive Clinical And Pathological Features«. American Journal of Medicine. 38 (2): 241–256. doi:10.1016/0002-9343(65)90178-6. PMID 14256720.
- ↑ Roskams T (Junij 2006). »Liver stem cells and their implication in hepatocellular and cholangiocarcinoma«. Oncogene. 25 (27): 3818–3822. doi:10.1038/sj.onc.1209558. PMID 16799623.
- ↑ Liu C, Wang J, Ou QJ (november 2004). »Possible stem cell origin of human cholangiocarcinoma«. World Journal of Gastroenterology. 10 (22): 3374–3376. doi:10.3748/wjg.v10.i22.3374. PMC 4572317. PMID 15484322.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Sell S, Dunsford HA (Junij 1989). »Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma«. American Journal of Pathology. 134 (6): 1347–1363. PMC 1879951. PMID 2474256.
- ↑ 47,0 47,1 Sirica AE (Januar 2005). »Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy«. Hepatology. 41 (1): 5–15. doi:10.1002/hep.20537. PMID 15690474. S2CID 10903371.
- ↑ Holzinger F, Z'graggen K, Büchler MW (1999). »Mechanisms of biliary carcinogenesis: a pathogenetic multi-stage cascade towards cholangiocarcinoma«. Annals of Oncology. 10 (Suppl 4): 122–6. doi:10.1023/A:1008321710719. PMID 10436802.
- ↑ Gores GJ (Maj 2003). »Cholangiocarcinoma: current concepts and insights«. Hepatology. 37 (5): 961–919. doi:10.1053/jhep.2003.50200. PMID 12717374. S2CID 5441766.
- ↑ Su CH, Tsay SH, Wu CC, Shyr YM, King KL, Lee CH, in sod. (april 1996). »Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma«. Annals of Surgery. 223 (4): 384–394. doi:10.1097/00000658-199604000-00007. PMC 1235134. PMID 8633917.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Rosen CB, Heimbach JK, Gores GJ (2008). »Surgery for cholangiocarcinoma: the role of liver transplantation«. HPB. 10 (3): 186–189. doi:10.1080/13651820801992542. PMC 2504373. PMID 18773052.
- ↑ Heimbach JK, Gores GJ, Haddock MG, Alberts SR, Pedersen R, Kremers W, in sod. (december 2006). »Predictors of disease recurrence following neoadjuvant chemoradiotherapy and liver transplantation for unresectable perihilar cholangiocarcinoma«. Transplantation. 82 (12): 1703–1707. doi:10.1097/01.tp.0000253551.43583.d1. PMID 17198263. S2CID 25466829.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Kuhlmann JB, Blum HE (Maj 2013). »Locoregional therapy for cholangiocarcinoma«. Current Opinion in Gastroenterology. 29 (3): 324–328. doi:10.1097/MOG.0b013e32835d9dea. PMID 23337933. S2CID 37403999.
- ↑ Luvira, V; Satitkarnmanee, E; Pugkhem, A; Kietpeerakool, C; Lumbiganon, P; Pattanittum, P (13. september 2021). »Postoperative adjuvant chemotherapy for resectable cholangiocarcinoma«. The Cochrane Database of Systematic Reviews. 2021 (9): CD012814. doi:10.1002/14651858.CD012814.pub2. PMC 8437098. PMID 34515993.
- ↑ Takada T, Amano H, Yasuda H, Nimura Y, Matsushiro T, Kato H, in sod. (Oktober 2002). »Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma«. Cancer. 95 (8): 1685–1695. doi:10.1002/cncr.10831. PMID 12365016.
- ↑ Todoroki T, Ohara K, Kawamoto T, Koike N, Yoshida S, Kashiwagi H, in sod. (Februar 2000). »Benefits of adjuvant radiotherapy after radical resection of locally advanced main hepatic duct carcinoma«. International Journal of Radiation Oncology, Biology, Physics. 46 (3): 581–587. doi:10.1016/S0360-3016(99)00472-1. PMID 10701737.
- ↑ Alden ME, Mohiuddin M (Marec 1994). »The impact of radiation dose in combined external beam and intraluminal Ir-192 brachytherapy for bile duct cancer«. International Journal of Radiation Oncology, Biology, Physics. 28 (4): 945–51. doi:10.1016/0360-3016(94)90115-5. PMID 8138448.
- ↑ González González D, Gouma DJ, Rauws EA, van Gulik TM, Bosma A, Koedooder C (1999). »Role of radiotherapy, in particular intraluminal brachytherapy, in the treatment of proximal bile duct carcinoma«. Annals of Oncology. 10 (Suppl 4): 215–220. doi:10.1023/A:1008339709327. PMID 10436826.
- ↑ Pitt HA, Nakeeb A, Abrams RA, Coleman J, Piantadosi S, Yeo CJ, in sod. (Junij 1995). »Perihilar cholangiocarcinoma. Postoperative radiotherapy does not improve survival«. Annals of Surgery. 221 (6): 788–97, discussion 797–788. doi:10.1097/00000658-199506000-00017. PMC 1234714. PMID 7794082.
- ↑ »National Comprehensive Cancer Network (NCCN) guidelines on evaluation and treatment of hepatobiliary malignancies« (PDF). Pridobljeno 13. marca 2007.
- ↑ »NCCN Guidelines for Patients: Gallbladder and Bile Duct Cancers; Hepatobiliary Cancers« (PDF). National Comprehensive Cancer Network. 2021. Pridobljeno 10. februarja 2021.
- ↑ Vauthey JN, Blumgart LH (Maj 1994). »Recent advances in the management of cholangiocarcinomas«. Seminars in Liver Disease. 14 (2): 109–114. doi:10.1055/s-2007-1007302. PMID 8047893. S2CID 37111064.
- ↑ 63,0 63,1 Boltežar G. Sistemsko zdravljenje malignih tumorjev jeter. Gastroenterolog 2022, suplement 1: 77-78.
- ↑ Glimelius B, Hoffman K, Sjödén PO, Jacobsson G, Sellström H, Enander LK, in sod. (Avgust 1996). »Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer«. Annals of Oncology. 7 (6): 593–600. doi:10.1093/oxfordjournals.annonc.a010676. PMID 8879373.
- ↑ Choi CW, Choi IK, Seo JH, Kim BS, Kim JS, Kim CD, in sod. (Avgust 2000). »Effects of 5-fluorouracil and leucovorin in the treatment of pancreatic-biliary tract adenocarcinomas«. American Journal of Clinical Oncology. 23 (4): 425–428. doi:10.1097/00000421-200008000-00023. PMID 10955877.
- ↑ Park JS, Oh SY, Kim SH, Kwon HC, Kim JS, Jin-Kim H, in sod. (Februar 2005). »Single-agent gemcitabine in the treatment of advanced biliary tract cancers: a phase II study«. Japanese Journal of Clinical Oncology. 35 (2): 68–73. doi:10.1093/jjco/hyi021. PMID 15709089.
- ↑ Giuliani F, Gebbia V, Maiello E, Borsellino N, Bajardi E, Colucci G (Junij 2006). »Gemcitabine and cisplatin for inoperable and/or metastatic biliary tree carcinomas: a multicenter phase II study of the Gruppo Oncologico dell'Italia Meridionale (GOIM)«. Annals of Oncology. 17 (Suppl 7): vii73–7. doi:10.1093/annonc/mdl956. PMID 16760299.
- ↑ Bhargava P, Jani CR, Savarese DM, O'Donnell JL, Stuart KE, Rocha Lima CM (september 2003). »Gemcitabine and irinotecan in locally advanced or metastatic biliary cancer: preliminary report«. Oncology. 17 (9 Suppl 8): 23–26. PMID 14569844.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Knox JJ, Hedley D, Oza A, Feld R, Siu LL, Chen E, in sod. (april 2005). »Combining gemcitabine and capecitabine in patients with advanced biliary cancer: a phase II trial«. Journal of Clinical Oncology. 23 (10): 2332–8. doi:10.1200/JCO.2005.51.008. PMID 15800324.
{navedi časopis}: Vzdrževanje CS1: samodejni prevod datuma (povezava)