Kombinatorna hemija
Kombinatorna hemija se sastoji od hemijskih sintetičkih metoda koji omogućavaju pripremu velikog broja (desetina do hiljada ili čak miliona) jedinjenja u pojedinačnom procesu. Kolekcije jedinjenja se mogu sastojati od smeša, setova pojedinačnih jedinjenja ili hemijskih struktura formiranih pomoću računarskog softvera. Kombinatorna hemija se može koristiti za sintezu malih molekula i peptida.
Strategije koje omogućavaju identifikaciju korisnih jedinjenja u kolekcijama su isto tako deo kombinatorne hemije. Metodi koji se koriste u kombinatornoj hemiji se takođe koriste izvan hemije.
Uvod
Sinteza molekula u kombinatornom maniru može brzo da dovede do velikog broja molekula. Na primer, molekul sa tri tačke raznovrsnosti (R1, R2, i R3) može da formira mogućih struktura, gde su , , i brojevi različitih supstituenata.
Osnovni princip kombinatorne hemije je da se pripreme kolekcije sa veoma velikim brojem jedinjenja, i da se zatim identifikuju korisna jedinjenja u kolekcijama.
Mada je kombinatorna hemija bila u industrijskoj primeni tek od 1990-tih, njeni koreni dosežu do 1960-tih, kad je istraživač sa Rokfelerovog univerziteta, Brus Merifild, započeo ispitivanje sinteze peptida u čvrstoj fazi.
U njenoj modernoj formi, kombinatorna hemija je veromatno izvršila najveći uticaj u farmaceutskoj industriji. Istraživači koji rade na optimizaciji profila aktivnosti jedinjenja kreiraju 'kolekciju' sa mnoštvom različitih ali srodnih jedinjenja. Napredak robotike je doveo do industrijskog pristupa kombinatornoj sintezi, omogućavajući rutinsku pripremu kolekcija sa preko 100.000 novih jedinjenja godišnje.
Da bi mogli da rukuju tako velikim brojem strukturnih mogućnosti, istraživači često kreiraju 'virtualnu kolekciju', računarsku enumeraciju svih mogućih struktura datog farmakofora sa svim dostupnim reaktantima.[1] Takva kolekcija se može sastojati od stotina miliona 'virtualnih' jedinjenja. Istraživači odabiraju podset 'virtualne kolekcije' za stvarnu sintezu na bazi raznih proračuna i kriterija (pogledajte ADME, računarska hemija, i QSAR).
Kombinatorna sinteza peptida
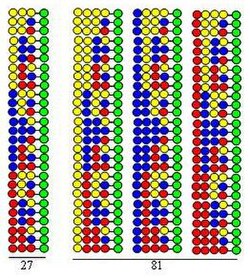
Kombinatorna “sinteza podele i mešanja”[2] je bazirana na sintezi čvrste faze koju je razvio Merifild.[3] Ako se kombinatorna peptidna kolekcija sintetiše koristeći 20 aminokiselina (ili drugih tipova gradivnih blokova) zrnca koja daju čvstu podršku se dele u 20 jednakih porcija. Tome sledi spajanja različitih aminokiselina u svakoj porciji. Treći korak je mešanje svih porcija. Ta tri koraka sačinjavaju ciklus. Elongacija peptidnih lanace se može ostvariti putem jednostavnog ponavljanja koraka ciklusa.

Procedura je ilustrovana sintezom dipeptidne kolekcije koristeći iste tri aminokiseline kao gradivne blokove u dva ciklusa. Svaka komponenta te kolekcije sadrži dve aminokiseline uređene u različitom redosledima. Aminokiseline koje se koriste u sparivanju su predstavljene žutim, plavim i crvenim krugovima na slici. Divergentne strelice označavaju podele rezina čvrste podloge (zeleni krugovi) u jednake proporcije, vertikalne strelice označavaju sprezanje i konvergentne strelice prestavljaju mešanje i homogeniziranje porcija podloge.
Slika prikazuje da se u dva sintetička ciklusa formira 9 dipeptida. U trećem i četvrtom ciklusu 27 tripeptida i 81 tetrapeptida bi se formiralo, respektivno.
Sinteza “podele i mešanja” ima nekoliko izuzetnih svojstava:
- Ona je visoko efikasna. Kao što slika demonstrira broj peptida formiranih u sintetičkom procesu (3, 9, 27, 81) se eksponencijalno povećava sa brojem izvršenih ciklusa. Koristeći 20 aminokiseline u svakom sintetičkom ciklusu broj formiranih peptida je: 400, 8,000, 160,000 i 3,200,000, respektivno.
- Sve peptidne sekvence se formiraju u procesu koji se može izvesti kombinacijom aminokiselina korištenih u ciklusima.
- Razdeljivanje podloge u jednake uzorke osigurava formiranje komponenti kolekcije u približno jednakim molarnim kvantitetima.
- Samo se jedan peptid formira na svakom zrncu podloge. To je posledica upotrebe samo jedne aminokiseline u koracima formiranja sprega. Međutim nije poznato koji peptid okupira koje zrnce.
- Metod podele i mešanja se može koristiti za sintezu organskih ili bilo koje druge vrste kolekcije koja se može pripremiti iz gradivnih blokova postepenim procesom.
Godine 1990, tri grupe su opisale metode za pripremu peptidnih kolekcija biološkim metodima[4][5][6] i godinu dana kasnije Fodor et al. su objavili izvanredan method za sintezu peptidnih nizova na malim staklenim pločicama.[7]
Metod “paralelne sinteze” je razvio Mario Geysen sa saradnicima radi pripreme peptidnih nizova.[8] Oni su sintetisali 96 peptida na plastičnim štapićima (iglama) obloženim na krajevima čvrstom podlogom. Igle su uronjene u rastvor reagensa smeštenog u otvorima mikrotitracione ploče. Metod je našao široku primenu posebno uz upotrebu automatskih paralelnih sintetizera. Mada je paralelni metod znatno sporiji od kombinatornog, njegova prednost je da je poznato koji peptid ili drugo jedinjenje se formira na svakoj igli.
Dalje procedure kojima se kombinuju prednosti metoda podele i mešanja sa paralelnom sintezom su razvijene. U metodu koji su opisale dve grupe[9][10] čvrsta podloga je smeštena u permeabilne plastične kapsule zajedno sa radiofrekventnom oznakom koja označava jedinjenje koje će se formirati u kapsuli. Primenjuje se procedura koja je slična sa metodom podele i mešanja. Međutim u koraku podele kapsule Se raspodeljuju među reakcionim posudama na bazi koda radiofrekventnih oznaka kapsula.
Različiti metod sa istom namenom su razvili Furka et al.[11] Metod se naziva nizna sinteza (engl. string synthesis). U ovom metodu kapsule nemaju kod. One su nanizane kao biseri ogrlice i stavljaju se u reakcione sudove u nanizanoj formi. Identitet kapsula, kao i njihov sadržaj, su poznati na osnovu njihove pozicije u nizu. Nakon nekoliko koraka sprezanja kapsule se raspodeljuju među novim nizovima na osnovu definisanih pravila.
Dekonvolucija i skrining
Sintetisani molekuli kombinatorne kolekcije se odvajaju od čvrste podloge i mešaju u rastvoru. U takvom rastvoru se nalaze milioni različitih jedinjenja. Kad je ovaj sintetički pristup razvijen, u početku je izgledalo nemoguće da se identifikuju molekuli, i da se nađu oni koji imaju korisna svojstva. Strategije prečišćavanja, identifikacije, i skrininga su naknadno razvijene da bi se rešio problem. Sve te strategije su bazirane na sintezi i testiranju parcijalnih kolekcija.
Najranija strategija, “iterativni metod” je opisana u gore pomenutom dokumentu koji je Furka napisao 1982. Identifikacija sekvenci aktivnog peptida obuhavata uzimanje uzorka nakon svakog sintetičkog koraka pre mešanja. Ovi uzorci se koriste u korak po korak identifikaciji testiranjem i kuplovanjem polazeći od N-terminusa.
Metod “pozicionog skeniranja”[12] je baziran na sintezi i testiranju serije potkolekcija u kojima je data pozicija sekvence u svim komponentama zauzeta istom aminokiselinom.
“Izostavne kolekcije”[13][14] u kojima date aminokiseline nedostaje u svim peptidima smeše, kao i “aminokiselinske test kolekcije”[15] koje sadrže peptide koji nedostaju u izostavnim kolekcijama se isto tako mogu koristiti u procesu dekonvolucije.
Ako peptidi nisu odvojeni od čvrste podloge radi se smešama granula, pri čemu svaka granula sadrži jedan peptid. Smit i njegovi saradnici[16] su pokazali da se peptidi mogu testirati u vezanoj formi. Ovaj pristup isto tako koristi skrining peptidnih kolekcija.[17] Kolekcija vezanih peptida se testira rastvorenim ciljnim proteinom. Granule za koje su vezani proteini se izdvoje; protein se odvoji od granula i zatim se identifikuje sekvenciranjem.
Donekle različit pristup su proizveli Tejlor i Morken.[18] Oni su koristili infracrvenu termografiju da identifikuju katalizatore kod nepeptidnih fiksiranh kolekcija. Kad su granule urone u rastvor supstrata, granule koje sadrže katalizator su sijaju zbog toplote koja se oslobođena u njima, te su mogu odvojiti.
Komponente kombinatorne kolekcije se isto tako mogu testirati jedna po jedna nakon odvajanja od pojedinačnih granula.
Kad se radi sa nepeptidnom organskim kolekcijama, nije jednostavno da se odredi identitet sadržaja granule kao što je to slučaj sa peptidima. Da bi se prevazišla ova poteškoća razvijeni su metodi za fiksiranje na granulama paralelno sa sintezom kolekcije, pri čemu se molekuli koji kodiraju identitet jedinjenjana formiranju u granuli. Fiksirani molekuli mogu da formiraju peptidne[19][20] ili nukleotidne[21][19] sekvence ili binarni kod.[22]
Nauka o materijalima
Tehnike kombinatorne hemije su našle primenu u nauci o materijalima. Pionirske doprinose su napravili P.G. Šultc et al. tokom devedesetih[23] u kontekstu luminescentnih materijala dobijenih putem kodepozicije elemenata na silicijumskom supstratu. Njegovom radu je predhodovao doprinos J. J. Hanaka 1970. godine[24] mada računarska i robotička oruđa nisu bila dostupna tako da metod nije nišao širu primenu u to vreme. Rad je nastavilo nekoliko akademskih grupa[25][26][27][28] kao i kompanije sa velikim istraživačkim i razvojnim programima (Symyx Technologies, GE, Dow Chemical etc.). Tehnika je ekstenzivno korištena za katalizu,[29] premaze,[30] elektroniku,[31] kao i u mnogim drugim poljima.[32] Primjena odgovarajućih informatičkih alata je kritična za rukovanje, administraciju, i skladištenje ogromne količine proizvedenih podataka.[33] Novi tipovi metoda dizajna eksperimenata su takođe razvijeni da bi se efikasno adresirali veliki eksperimentalni prostori koji su dostupni koristeći kombinatorne metode.[34]
Raznovrsnot hemijskih kolekcija
Mada je kombinatorna hemija bila esencijalni deo ranih istraživanja lekova tokom perioda koji premašuje dve dekade, do sada je samo jedna de novo kombinatorno hemijski sintetisana hemikalija odobrena za kliničku upotrebu od strane FDA (sorafenib, multikinazni inhibitor koji se koristi u tretmanu napredne faze raka bubrega).[35] Analiza niske stope uspešnosti ovog pristupa sugeriše da je jedan od razloga znatna ograničenost hemijskog prostora koji je pokriven produktima kombinatorne hemije.[36] Pri upoređivanju svojstava jedinjenja kombinatornih hemijskih kolekcija sa svojstvima odobrenih lekova i prirodnih produkata, Feher i Šmidt[36] su uočili da kombinatorne hemijske kolekcije imaju nizak stepen hiralnosti i strukturne rigidnosti, što je u suprotnosti sa svojstvima lekova. Mada prirodni produkti nisu zadnjih dogina bili popularni u polju razvoja lekova, znatna proporcija novih hemijskih entiteta su još uvek jedinjenja izvedena iz prirodnih produkata, i stoga se smatra da bi efektivnost kombinatorne hemije mogla da se poboljša povećanjem hemijske raznovrstnosti kolekcija za skrining.[37]
Patentna klasifikaciona podklasa
U 8. izdanju Međunarodne patentne klasifikacije (IPC), koje je stupilo na snagu 1. januara 2006, specijalna potklasa je kreirana za patentne aplikacije i patente vezane za ispitivanja u domenu kombinatorne hemije: "C40B".
Vidi još
- Kombinatorika
- Heminformatika
- Kombinatorna biologija
- Otkrivanje lekova
- Dinamička kombinatorna hemija
- Visokopropusni skrining
- Matematička hemija
- Molekulsko modelovanje
Reference
- ^ Gordeeva, Ekaterina V.; Lushniknov, Dmitri E.; Zefirov, Nikolai S. (1992). „COMPASS Program - an Original Semi-Emperical Approach to Computer-Assisted Synthesis”. Tetrahedron. 48 (18): 3789—3804. doi:10.1016/S0040-4020(01)92270-7.
- ^ Á. Furka, F. Sebestyen, M. Asgedom, G. Dibo, General method for rapid synthesis of multicomponent peptide mixtures. Int. J. Peptide Protein Res., 1991, 37, 487-493.
- ^ Merrifield RB, 1963 J. Am. Chem. Soc. 85, 2149.
- ^ J. K. Scott and G. P. Smith Science 1990, 249, 404.
- ^ S. Cwirla, E. A. Peters, R. W. Barrett and W. J. Dower Proc. Natl. Acad. Sci. USA 1990, 87, 6378.
- ^ J. J. Devlin, L. C. Panganiban and P. E. Devlin Science 1990, 249, 404.
- ^ Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D, 1991. Light-directed, spatially addressable parallel chemical synthesis. Science 251, 767-73.
- ^ H. M. Geysen, R. H. Meloen, S. J. Barteling Proc. Natl. Acad. Sci. USA 1984, 81, 3998.
- ^ E. J. Moran, S. Sarshar, J. F. Cargill, M. Shahbaz, A Lio, A. M. M. Mjalli, R. W. Armstrong J. Am. Chem. Soc. 1995, 117, 10787.
- ^ K. C. Nicolaou, X –Y. Xiao, Z. Parandoosh, A. Senyei, M. P. Nova Angew. Chem. Int. Ed. Engl. 1995, 36, 2289.
- ^ Á. Furka, J. W. Christensen, E. Healy, H. R. Tanner, H. Saneii J. Comb. Chem. 2000, 2, 220.
- ^ Á. Furka, F. Sebestyén WO 93/24517.
- ^ T. Carell, E. A. Winter, J. Rebek Jr. Angew. Chem. Int. Ed. Engl. 1994, 33, 2061.
- ^ E. Câmpian, M. Peterson, H. H. Saneii, Á. Furka Bioorg. & Med. Chem. Letters 1998, 8, 2357.
- ^ E. Câmpian, J. Chou, M. L. Peterson, H. H. Saneii, Á. Furka, R. Ramage, R. Epton (Eds) In Peptides 1996, 1998, Mayflower Scientific Ltd. England, 131.
- ^ J. A. Smith J. G. R. Hurrel, S. J. Leach Immunochemistry 1977, 14, 565.
- ^ K. S. Lam, S. E. Salmon, E. M. Hersh, V. J. Hruby, W. M. Kazmierski, R. J. Knapp Nature 1991, 354, 82; and its correction: K. S. Lam, S. E. Salmon, E. M. Hersh, V. J. Hruby, W. M. Kazmierski, R. J. Knapp Nature 1992, 360, 768.
- ^ S. J. Taylor, J. P. Morken Science 1998, 280, 267.
- ^ а б J. Nielsen, S. Brenner, K. D. Janda J. Am. Chem. Soc. 1993, 115, 9812.
- ^ V. Nikolaiev, A. Stierandova, V. Krchnak, B. Seligman, K. S. Lam, S. E. Salmon, M. Lebl Pept. Res. 1993, 6, 161.
- ^ S. Brenner and R. A. Lerner Proc. Natl. Acad. Sci. USA 1992, 89, 5381.
- ^ M. H. J. Ohlmeyer, R. N. Swanson, L. W. Dillard, J. C. Reader, G. Asouline, R. Kobayashi, M. Wigler, W. C. Still Proc. Natl. Acad. Sci. USA 1993, 90, 10922.
- ^ X. -D. Xiang et al. "A Combinatorial Approach to Materials Discovery" Science 268 (1995) 1738
- ^ J.J. Hanak, J. Mater. Sci, 1970, 5, 964-971
- ^ Combinatorial methods for development of sensing materials, Springer. 2009. ISBN 978-0-387-73712-6.
- ^ V. M. Mirsky, V. Kulikov, Q. Hao, O. S. Wolfbeis. Multiparameter High Throughput Characterization of Combinatorial Chemical Microarrays of Chemosensitive Polymers. Macromolec. Rap. Comm., 2004, 25, 253-258
- ^ Koinuma, H.; Aiyer, H.N.; Matsumoto, Y. (2000). „Combinatorial solid state materials science and technology”. Science and Technology of Advanced Materials. 1 (1): 1—10. Bibcode:2000STAdM...1....1K. S2CID 137661433. doi:10.1016/S1468-6996(00)00003-6.
- ^ Mardare, Andrei Ionut; Yadav, Amar Prasad; Wieck, Andreas Dirk; Stratmann, Martin; Hassel, Achim Walter (2008). „Combinatorial electrochemistry on Al–Fe alloys”. Science and Technology of Advanced Materials. 9 (3): 035009. Bibcode:2008STAdM...9c5009I. PMC 5099663
 . PMID 27878006. doi:10.1088/1468-6996/9/3/035009.
. PMID 27878006. doi:10.1088/1468-6996/9/3/035009.
- ^ Applied Catalysis A, Volume 254, Issue 1, Pages 1-170 (10 November 2003)
- ^ , J. N. Cawse et. al, Progress in Organic Coatings, Volume 47, Issue 2, August 2003, Pages 128-135
- ^ Combinatorial Methods for High-Throughput Materials Science, MRS Proceedings Volume 1024E, Fall 2007
- ^ Combinatorial & Artificial Intelligence Methods in Materials Science II, MRS Proceedings Volume 804, Fall 2004
- ^ QSAR & Combinatorial Science, 24, Number 1 (February 2005)
- ^ J. N. Cawse, Ed., Experimental Design for Combinatorial and High Throughput Materials Development, John Wiley and Sons, 2002.
- ^ Newman, David J.; Cragg, Gordon M. (2007). „Natural Products as Sources of New Drugs over the Last 25 Years”. Journal of Natural Products. 70 (3): 461—477. PMID 17309302. doi:10.1021/np068054v.
- ^ а б M. Feher and J. M. Schmidt "Property Distributions: Differences between Drugs, Natural Products, and Molecules from Combinatorial Chemistry" J. Chem. Inf. Comput. Sci., 43 (2003) 218
- ^ Su QB, Beeler AB, Lobkovsky E, Porco JA, Panek JS "Stereochemical diversity through cyclodimerization: Synthesis of polyketide-like macrodiolides." Org Lett 2003, 5:2149-2152.
Spoljašnje veze
- English version of the 1982 document
- “The concealed side of the history of combinatorial chemistry”
- IUPAC's "Glossary of Terms Used in Combinatorial Chemistry"
- ACS Combinatorial Science (formerly Journal of Combinatorial Chemistry)
- Combinatorial Chemistry Review
- Molecular Diversity
- Combinatorial Chemistry and High Throughput Screening
- Combinatorial Chemistry: an Online Journal
- SmiLib - A free open-source software for combinatorial library enumeration
- GLARE - A free open-source software for combinatorial library design



