கனசதுரம் (படிக முறை)



படிகவுருவியலில் கனசதுர படிக அமைப்பு என்பது கனசதுர வடிவ அலகுஅறை கொண்ட ஒரு படிக அமைப்பாகும். படிகங்களிலும் தனிமங்களிலும் காணப்படும் வடிவங்களில் மிக அதிகமாக காணப்படும் வடிவங்களில் இதுவும் ஒன்றாகும்.
இவ்வமைப்பில் மூன்று முக்கிய வகைகள் (ப்ராவை அணிக்கோவைகள்) உள்ளன:
- மூல கனசதுரம் (cP என்று குறிக்கப்படும், சாதரண கனசதுரம் என்றும் அறியப்படும்)
- பொருள்மைய கனசதுரம் (cI என்று குறிக்கப்படும்)
- முக மைய கனசதுரம் (cF என்று குறிக்கப்படும், கனசதுர நெருக்கப் பொதிவமைப்பு என்றும் அறியப்படும்)[1][2][3]
இப்படிக அமைப்புகளில் அலகறைகள் கனசதுரம் என்று வழக்கத்தில் கொள்ளப்படும் பொழுதிலும், பெரும்பாலும் மூல அலகறை கனசதுரமாய் இருப்பதில்லை என்பது குறிக்கத்தக்கது. இதன் காரணம் பெரும்பான்மையான படிக அமைப்புகளின் அலகறைகள் ஒன்றுக்கு மேற்பட்ட அணுக்களை (அல்லது அணிக்கோவை புள்ளிகளை) கொண்டனவாய் இருக்கின்றன என்பதே ஆகும்.
கனசதுர இடக்குழுக்கள்
கனசதுர படிக அமைப்பினை ஆக்கும் மூன்று ப்ராவை அணிக்கோவைகளாவன:
| பெயர் | மூல கனசதுரம் | பொருள்மைய கனசதுரம் | முகமைய கனசதுரம் |
|---|---|---|---|
| பியர்சன் குறியீடு | cP | cI | cF |
| அலகுஅறை | 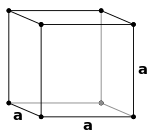
|
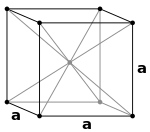
|

|
மூல கனசதுர அமைப்பு தன் ஒவ்வொரு மூலையிலும் ஒரு அணிக்கோவை புள்ளியினைக் கொண்டிருக்கும். ஒரு அணிக்கோவை புள்ளியில் இருக்கும் ஒவ்வொரு அணுவும் அடுத்தடுத்து இருக்கும் எட்டு கனசதுரங்களால் (அலகறைகளால்) சமமாய் பகிர்ந்துகொள்ளப்படும், எனவே ஒர் அலகறை மொத்தத்தில் ஒரே ஒரு அணுவினையே கொண்டிருக்கும் (1/8 x 8).
பொருள்மைய கனசதுர அமைப்பு எட்டு மூலைகளோடு கூடுதலாய் அலகறையின் மையத்திலும் ஒரு அணிக்கோவை புள்ளியினைக் கொண்டிருக்கும். இதில் ஆக மொத்தம் 2 அணிக்கோவை புள்ளிகள் இருக்கும் (1/8 x 8 மூலை + 1 மையம்).
முகமைய கனசதுர அமைப்பில் அலகறையின் ஒவ்வொரு முகத்திலும் ஒரு அணிக்கோவை புள்ளி இருக்கும், இவை ஒவ்வொன்றும் சரியாய் இரண்டு அடுத்தடுத்த அலகறைகளால் பகிரப்படும், இவற்றைத் தவிர எட்டு மூலைப் புள்ளிகளும் இருக்கும். ஆக இவ்வமைப்பில் ஓர் அலகறையில் மொத்தம் 4 அணிக்கோவை புள்ளிகள் இருக்கும் (1/8 x 8 மூலை + 1/2 x 6 முகம்)
முகமைய கனசதுர அமைப்பானது அறுகோண நெருக்கப் பொதிவு அமைப்புடன் மிக நெருங்கிய தொடர்புடையது ஆகும், இவ்விரண்டு அமைப்புகளும் தங்கள் அறுகோண அடுக்குகளின் பொருந்துநிலைகளில் மட்டுமே வேறுபடுகின்றன. முக மைய கனசதுர அமைப்பின் [111] தளம் ஒரு அறுகோண படலமே ஆகும்.
அலகறையின் வெற்றிடங்கள்
பொதுவில் அணுக்கள் இன்ன பருமன் உடையது என்று உறுதியாய் வரையறுக்க இயலாதனவாய் இருந்தாலும், ஒரு படிக அமைப்பில் ஒன்றொடு ஒன்று அடுக்கி அணுக்கள் அமைகையில் அவற்றை ஒரு கோளமாய் கருத இயலும். இவ்வாறு அணுக்கோளங்கள் அமைகையில் அவற்றிற்கு இடையே வெற்றிடங்கள் இருக்கும், இதனையே வெற்றிடம் (Void) என்று அழைப்பர்.
சாதரண (அல்லது, மூல) கனசதுரம் நடுவில் மட்டும் ஒரே ஒரு வெற்றிடத்தைக் கொண்டது.
பொருள்மைய கனசதுரம் ஒவ்வொரு முகத்திலும் ஒன்று என ஆறு எண்முக வெற்றிடங்களைக் கொண்டது, ஆயினும் ஒவ்வொரு முகத்தின் வெற்றிடமும் இரண்டிரண்டு அலகறைகளால் பகிர்ந்துகொள்ளப்படுவதால், ஒரு அலகறை மூன்று வெற்றிடங்களை மட்டுமெ மொத்தத்தில் கொண்டிருக்கும். கூடுதலாய், ஒவ்வொரு எண்முகத்தைச் சுற்றியும் நான்முக வெற்றிடங்கள் இருக்கும், இவை எண்ணிக்கையில் 36 ஆகவும், மொத்தத்தில் 18 ஆகவும் இருக்கும். இந்த நான்முக வெற்றிடங்கள் உண்மையில் வெற்றிடங்கள் அல்ல என்றாலும் பல்லணு அலகறைகளில் இவை சிலவேளைகளில் தோன்றும்.
முகமைய கனசதுரம் அலகறையின் ஒவ்வொரு மூலையிலும், சற்றே மையத்திற்கு அருகில் என, எட்டு நான்முக வெற்றிடங்களைக் கொண்டிருக்கும், இவை ஆக மொத்தம் எட்டு நான்முக வெற்றிடங்களாகும். கூடுதலாய், அலகறையின் ஒவ்வொரு முனையின் மையத்திலும் ஒன்று என 12 எண்முக வெற்றிடங்களையும், அலகறையின் நடுவில் ஒரு எண்முக வெற்றிடத்தையும் கொண்டிருக்கும்.
அணுப்பொதிவுக் கூறு (அல்லது அணு கட்டு பின்னம்)
படிக அமைப்பின் முக்கியமானதொரு பண்பு அதன் அணுப்பொதிவுக் கூறு ஆகும். ஒத்த கோளங்களாய் கருதப்படும் அணுக்கள் ஓர் அலகறையின் மொத்த கொள்ளளவில் எத்துணை இடத்தை நிரப்புகின்றன என்ற விகதமே அணு பொதிவுக் கூறு ஆகும் (அதாவது ஓர் அலகறையின் அணுக்களின் மொத்த கொள்ளளவை அவ்வலகறையின் கொள்ளளவால் வகுக்கக் கிடைக்கும் பின்னம்.)
ஒரு மூல கனசதுர அணிக்கோவையில் ஒவ்வொரு அணிக்கோவை புள்ளியிலும் ஒரு அணு இருப்பதாய் கொண்டு, கனசதுரத்தின் பக்க நீளம் ‘a' எனக் கொண்டால், அணுவின் ஆரம் ‘a/2' ஆகும், இதன் அணு பொதிவுக் கூறு 0.542 எனவாகும் (இது மிக குறைவானது). அதே போல, ஒரு பொருள்மைய கனசதுரத்தில், அணு பொதிவுக் கூறு 0.680 ஆகவும், முகமைய கனசதுரத்தின் பொதிவுக்கூறு 0.740 ஆகவும் இருக்கும். கோட்பாட்டளவில், எல்லா அணிக்கோவைகளிலும் முகமைய கனசதுர அணிக்கோவையே மிக அதிக அணுப் பொதிவுக் கூற்றைப் பெற சாத்தியமானதாகும், எனினும் அறுகோண நெருக்கப் பொதிவு மற்றும் ஒருவகை நான்முக பொருள்மைய கனசதுரம் ஆகியவையும் கூட இதே அணுப் பொதிவுக் கூற்றை (0.740) பெருகின்றன.
ஒரு விதியாய், ஒரு திடப்பொருளில் இருக்கும் அணுக்கள் ஒன்றையொன்று கவர்கின்றன என்பதினால், அதிக நெருக்கமாய் பொதியப் பெற்ற அணு அமைப்புகளே அதிகவளவில் காணக்கிடைப்பன. (தளர்வாய் பொதியப் பெற்ற அமைப்புகளும் இயற்கையில் இருக்கின்றன, சில பிணைப்புக் கோணங்களுக்கு அவை ஏற்புடையதாய் இருப்பதினால்). இதனால், குறைந்த அணுப் பொதிவுக் கூறு உடைய மூல கனசதுர அமைப்பு இயற்கையில் மிக அரிதாகவே காணப்படுகிறது, பொலோனியத்தில் இவ்வமைப்பே உள்ளது. ஆனால், அதிக அடர்த்தி கொண்ட பொருள்மைய கனசதுர மற்றும் முகமைய கனசதுர அமைப்புகள் இயற்கையில் மலிந்து கிடக்கின்றன. பொருள்மைய கனசதுரத்திற்கு எடுத்துக்காட்டுகள் இரும்பு, குரோமியம், டங்ஸ்டன் மற்றும் நியோபியம். அலுமினியம், செம்பு, தங்கம் மற்றும் வெள்ளி ஆகியன முகமைய கனசதுரத்திற்கு எடுத்துக்காட்டுகள்.
பல்தனிமச் சேர்மங்கள்
ஒன்றுக்கு மேற்பட்ட தனிமங்களால் ஆன சேர்மங்கள் (ஈர்தனிம சேர்மம் போன்றவை) பெரும்பாலும் கனசதுர அமைப்பை அடிப்படையாய் கொண்ட படிக அமைப்புகளையே பெற்றிருக்கின்றன. அதிகமாய் காணப்படும் சில சேர்மங்களின் அமைப்புகள் இங்கே விவரிக்கப்பட்டுள்ளன.
ஊடுருவும் மூல கனசதுர அமைப்பு (சீசியம் குளோரைடு)

பல்தனிமச் சேர்மங்களின் அமைப்பில் ஒன்று “ஊடுருவும் மூல கனசதுர” அமைப்பு, இது “சீசியம் குளோரைடு” அமைப்பு என்றும் அறியப்படும். இதன் இருவேறு அணுக்களும் தனித்தனியாய் ஒவ்வொரு மூலகனசதுர அணிக்கோவையில் அமையும், ஒருவகை அணுவின் கனசதுரத்தின் மையத்தில் மற்றொரு வகை அணு அமையும். மொத்தத்தில், இவ்வமைப்பு பொருள்மைய கனசதுரத்தை ஒத்திருக்கும், ஆனால் வெவ்வேறு அணிக்கோவை புள்ளிகளில் (அதாவது, மூலை மற்றும் மையம்) வெவ்வேறு அணுக்கள் இருக்கும் (சீசியம் மற்றும் குளோரைடு போன்று, காண்க படம்).
இவ்வமைப்பு கொண்ட சேர்மங்களுக்கு எடுத்துக்காட்டாய் சீசியம் குளோரைடே இருக்கும், மேலும் குறைந்த வெப்பத்தில் அல்லது அதிக அழுத்தத்தில் தயாரிக்கப்படும் கார ஹாலைடுகளும் இருக்கும். பொதுவில், இவ்வகை அமைப்பு ஒத்த அளவுடைய அயனிகளைக் கொண்ட இரண்டு தனிமங்களின் சேர்மங்களில் காணக்கூடியதாகும் (சீசியம் குளோரைடில், சீசியம் அயனியின் Cs+ ஆரம் 167 pm, குளோரைடு அயனியின் Cl- ஆரம் 181 pm ஆகும்).
இவ்வமைப்பின் இடக்குழு Pm3m என்று அழைக்கப்படும் (ஹெர்மன் - மாகின் குறியீட்டுமுறையில்), அல்லது “221” என்று (படிகவுருவியலுக்கான சர்வதேச அட்டவணையில்). இதன் ஸ்ட்ரக்டர்பெரிச் குறிப்பெயர் “B2" என்பது.
இவ்வமைபில் உள்ள ஒவ்வொரு அணுவிற்கும் அணைவு எண் (coordination number) 8 ஆகும்: ஒரு மைய நேரயனி 8 மூலையில் உள்ள எதிரயனிகளோடும் அணைவு பெறும், அதேபோல ஒவ்வொரு மைய எதிரயனியும் 8 மூலைகளில் உள்ள நேரயனிகளோடு அணைவு பெறும், படத்தில் காட்டப்பட்டுள்ளதைப் போல்.
இந்துப்பு அமைப்பு

பலதனிமச் சேர்மங்களில் மற்றோர் அமைப்பு “இந்துப்பு” அல்லது “சோடியம் குளோரைடு” அமைப்பாகும். இதில் இருவேறுபட்ட அணுவகைகளும் தனித்தனியாக ஒவ்வொரு முகமைய கனசதுர அமைப்பில் இருக்கும், இவ்விரண்டு அமைப்புகளும் ஒரு முப்பரிமாண சதுரங்கப்பலகையைப் போல ஊடுருவி அமையும் (அருகிலிருக்கும் படத்தில் காண்க.) வேறுமுறையில், இவ்வமைப்பை தன் எண்முக வெற்றிடங்களில் வேறோர் அணுவைக்கொண்ட ஒரு பொருள்மைய கனசதுரமாகவும் கொள்ளலாம்.
இவ்வகை சேர்மங்களுக்கு எடுத்துக்காட்டாய் சோடியம் குளோரைடே விளங்கும், இதனுடன் கிட்டத்தட்ட அனைத்து கார ஹாலைடுகளும், பல இருஇணைதிற உலோக ஆக்சைடுகளும், சல்பைடுகளும், செலனைடுகளும், டெல்லூரைடுகளும் விளங்கும். பொதுவில், எதிரயனியைவிட நேரயனி சற்றே சிறியதாக இருக்கும் நிலையில் இவ்வமைப்பு உருவாக அதிக வாய்ப்பு ஏற்படுகிறது (நேரயனி/எதிரயனி ஆர விகிதம் 0.414 முதல் 0.732 வரை இருந்தால்.)
இவ்வமைப்பின் இடக்குழு Fm3m என்று அழைக்கப்படும் (ஹெர்மன் - மாகின் குறியீட்டுமுறையில்), அல்லது “225” என்று (படிகவுருவியலுக்கான சர்வதேச அட்டவணையில்). இதன் ஸ்ட்ரக்டர்பெரிச் குறிப்பெயர் “B1" என்பது.
இவ்வமைப்பின் ஒவ்வோர் அணுவிற்கும் அணைவு எண் 6 ஆகும்: ஒவ்வொரு நேரயனியும் எண்முக வடிவின் முனைகளில் அமைந்த 6 எதிரயனிகளுடன் அணைவு பெறும், அதே போல் ஒவ்வொரு எதிரயனியும் 6 நேரயனிகளுடன் அணைவு பெறும்.
இந்துப்பு அமைப்பில் உள்ள சில படிகங்களின் அணுவிடைத் தொலைவு (அதாவது, நேரயனி மற்றும் எதிரயனி இடையேயான நீளம், அல்லது அலகறையின் நீளத்தில் பாதி) பின்வருமாறு: NaF-க்கு 2.3 Å (2.3 × 10−10 m), NaCl-க்கு 2.8 Å, மற்றும் SnTe-க்கு 3.2 Å.
துத்தநாகக் கந்தக அமைப்பு

பல்தனிமச் சேர்மங்களில் அதிகமாய் காணப்படும் மற்றோர் அமைப்பு “துத்தநாகக் கந்தக” அமைப்பாகும். இது துத்தநாகக் கந்தக தனிமத்தினால் (ஸ்ஃபலரைட்டு) இப்பெயர் பெற்றது. இந்துப்பு அமைப்பில் இருப்பது போலவே இவ்வமைப்பிலும் இரண்டு வெவ்வேறு அணுக்களினால் அமைந்த இரண்டு தனித்தனி முகமைய கனசதுரங்கள் ஒன்றுக்கொன்று ஊடுருவி இருக்கும், ஆனால், இவ்விரண்டு தனித்தனி அணிக்கோவைகளும் ஒன்றைப் பொருத்து மற்றது எவ்வாறு அமைந்துள்ளது என்பதில் இவ்வமைப்பு வேறுபடுகிறது. துத்தநாகக் கந்தக அமைப்பு நான்முக அணைவு கொண்டது: ஒரு தனிமத்தின் ஒவ்வொரு அணுவிற்கும் நான்கு மற்றொரு தனிமத்தின் அணுக்கள் அணைவில் இருக்கும்; இந்நான்கும் அவ்வணுவினை மையத்தில் கொண்டதொரு சீரான நான்முகவடிவின் முனைகளைப் போல அமைந்திருக்கும். ஆகமொத்தம், துத்தநாகக் கந்தக அமைப்பு வைர கனசதுர அமைப்பினைப் போன்றதே ஆகும், ஆனால் வெவ்வேறு அணிக்கோவை புள்ளிகளில் இருவேறு அணுக்களை மாறிமாறிக் கொண்டிருக்கும் (அருகிலிருக்கும் படத்தில் காண்க.)
இவ்வகைச் சேர்மங்களுக்கு எடுத்துக்காட்டாய் துத்தநாகக் கந்தகமே அமையும், மேலும் காரீய(II) நைட்ரேட், பல சேர்ம குறைகடத்திகள் (காலியம் ஆர்செனைடு மற்றும் காட்மியம் டெல்லூரைடு போன்றவை), மற்றும் பலதரப்பட்ட பிற இருதனிமச் சேர்மங்கள்.
மேலும், இவ்வமைப்பில் உள்ள இரண்டு தனிமங்களுமே கார்பன் என்று கொள்ளும் நிலையில், துத்தநாகக் கந்தக அமைப்பு வைர கனசதுர அமைப்பிற்கு ஈடானதாகவே இருக்கும்.
இவ்வமைப்பின் இடக்குழு F43m என்று அழைக்கப்படும் (ஹெர்மன் - மாகின் குறியீட்டுமுறையில்), அல்லது “#216” என்று (படிகவுருவியலுக்கான சர்வதேச அட்டவணையில்). இதன் ஸ்ட்ரக்டர்பெரிச் குறிப்பெயர் “B3" என்பது.
மேற்கோள்கள்
- ↑ De Wolff, P. M.; Belov, N. V.; Bertaut, E. F.; Buerger, M. J.; Donnay, J. D. H.; Fischer, W.; Hahn, Th.; Koptsik, V. A. et al. (1985). "Nomenclature for crystal families, Bravais-lattice types and arithmetic classes. Report of the International Union of Crystallography Ad-Hoc Committee on the Nomenclature of Symmetry". Acta Crystallographica Section A 41 (3): 278. doi:10.1107/S0108767385000587.
- ↑ Prince, E., ed. (2006). International Tables for Crystallography. எண்ணிம ஆவணச் சுட்டி:10.1107/97809553602060000001. பன்னாட்டுத் தரப்புத்தக எண் 978-1-4020-4969-9. S2CID 146060934.
- ↑ Crystallography and Minerals Arranged by Crystal Form, Webmineral