Amoni nitrat
| Ammonium nitrate | |
|---|---|
| |
| General | |
| Tên hoá học | Ammonium nitrate |
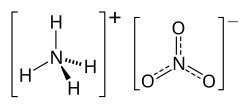
| Công thức hóa học | NH4NO3 |
| Khối lượng mol | 80.04336 g/mol |
| Bề ngoài | rắn trắng |
| CAS number | 6484-52-2 |
| Properties | |
| Tỷ trọng và phase | 1.73 g/cm³, rắn |
| Độ hòa tan trong nước | 119 g/100 ml (0 °C) 190 g/100 ml (20 °C) 286 g/100 ml (40 °C) 421 g/100 ml (60 °C) 630 g/100 ml (80 °C) 1024 g/100 ml (100 °C) |
| Điểm nóng chảy | 169 °C |
| Điểm sôi | khoảng. 210 °C decomp |
| Tốc độ nổ | 5,270 m/s |
| Critical relative humidity | 78% (0 °C) 65% (20 °C) 58.5% (30 °C) 52.5% (40 °C) 46.5% (50 °C) 41% (60 °C) |
| Hàm lượng nitơ | 34.5%N |
| Structure | |
| Coordinationgeometry | ? |
| Crystal structure | trigonal |
| Hazards | |
| MSDS | External MSDS |
| EU classification | not listed |
| RTECS number | BR9050000 |
| Supplementary data page | |
| Structure andproperties | n, εr, etc. |
| Thermodynamicdata | Phase behaviour Solid, liquid, gas |
| Spectral data | UV, IR, NMR, MS |
| Related compounds | |
| Other anions | Amoni nitrit Amoni perchlorat |
| Other cations | Natri nitrat Kali nitrat Hydroxylammonium nitrat |
| Related compounds | Nitrous oxide |
| Except where noted otherwise, data are given for materials in their standard state (at 25 °C, 100 kPa) Infobox disclaimer and references | |
Amoni nitrat là một hợp chất hóa học, là nitrat của amonia với công thức hóa học NH4NO3, là một chất bột màu trắng tại nhiệt độ phòng và áp suất tiêu chuẩn. Chất này thường được dùng trong nông nghiệp làm phân bón[1] và cũng được sử dụng làm chất oxy hóa trong thuốc nổ, đặc biệt là các thiết bị nổ tự tạo.
Sử dụng làm chất nổ
Là một chất oxy hóa mạnh, nitrat amoni tạo thành một hỗn hợp nổ khi kết hợp với nhiên liệu như hydro, thường là dầu diesel (dầu) hoặc đôi khi dầu hòa. Do amoni nitrat và dầu nhiên liệu (ANFO) thường có sẵn, hỗn hợp ANFO trong nhiều trường hợp được sử dụng trong các bom tức thì, ví dụ như vụ đánh bom Thành phố Oklahoma vào năm 1995 tại Mỹ
Nitrat amoni được sử dụng trong các thuốc nổ quân sự như bom daisy cutter và là một thành phần của amatol. Các hỗn hợp sử dụng trong quân sự thường pha ~20% bột nhôm nữa để tăng sức nổ. Một ví dụ là Ammonal, có chứa amoni nitrat, trinitrotoluene(TNT), nhôm và lượng ít than củi
Ngày 4 tháng 8 năm 2020, Vụ nổ nhà kho tại Beirut do amoni nitrat với sức công phá ngang ~1200 tấn TNT, vụ nổ kho chứa 2.750 tấn amoni nitrat ở cảng Beirut, thủ đô Liban, đã làm chết ít nhất 159 người và hơn 6000 người bị thương.
Các ứng dụng khác

Ứng dụng phổ biến nhất của nitrat amoni là làm phân bón. Ứng dụng này là do nó có chứa nhiều ni tơ (cần thiết cho cây trồng vì cây cần ni tơ để tạo ra các protein) và được sản xuất công nghiệp với giá không đắt. Nitrat Amoni cũng được sử dụng trong các túi lạnh nhanh (instant cold pack). Trong ứng dụng này, nitrat amoni được trộn với nước trong một phản ứng thu nhiệt, với nhiệt lượng 26,2 kilojun mỗi mol chất phản ứng. Các sản phẩm của các phản ứng nitrat amoni được ứng dụng trong các túi khí. Chất azit natri (NaN3) là hóa chất được sử dụng trong các túi khí và nó phân hủy tạo ra natri (Na) và nitơ (N2).
Nitrat amoni được ứng dụng trong việc xử lý các quặng titanium.
Nitrat amoni được sử dụng trong việc việc điều chế chất Dinito monoxide (N2O):
- NH4NO3(aq) -> N2O(g) + 2H2O(l)
Nitrat amoni có thể được sử dụng để điều chế amonia khan, một hóa chất thường được sử dụng trong việc sản xuất methamphetamine.
Sản xuất nitrat amoni
Việc sản xuất nitrat amoni công nghiệp thì đơn giản về mặt hóa học dù về công nghệ thì đầy thách thức. Phản ứng trung hòa của amonia với acid nitric tạo ra một dung dịch nitrat amoni: HNO3(aq) + NH3(g) → NH4NO3(aq). Để sản xuất quy mô công nghiệp, phản ứng này được thực hiện bằng cách sử dụng khí amonia khan và acid nitric đậm đặc. Phản ứng này xảy ra mãnh liệt và tỏa nhiệt. Người không chuyên nghiệp và không có thiết bị chuẩn bị sẵn không nên thử nghiệm với khí khan và acid đặc như thế này, dù với sự pha loãng lớn bởi nước, không nên xem thí nghiệm kiểu này là dễ. Sau khi dung dịch muối được tạo ra, thường thì có nồng độ khoảng 83%, lượng nước dư được làm khô đến mức nitrat amoni có nồng độ 95 - 99,9% (nitrat amoni chảy), tùy theo mức độ.
| NFPA 704 "Biểu đồ cháy" |
|---|
Chú thích
- ^ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
Liên kết ngoài
- "Storing and Handling Ammonium Nitrate", UK Health and Safety Executive publication INDG230 (1986)
- Properties: UNIDO and International Fertilizer Development Center (1998), Fertilizer Manual, Kluwer Academic Publishers, ISBN 0-7923-5032-4.
| HNO3 | He | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 |
C | NO− 3, NH4NO3 |
O | FNO3 | Ne | ||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClNO3 | Ar | ||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4, TiO(NO3)2 |
V(NO3)2, V(NO3)3, VO(NO3)2, VO(NO3)3, VO2NO3 |
Cr(NO3)2, Cr(NO3)3, CrO2(NO3)2 |
Mn(NO3)2, Mn(NO3)3 |
Fe(NO3)2, Fe(NO3)3 |
Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | CuNO3, Cu(NO3)2 |
Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4, ZrO(NO3)2 |
Nb | Mo(NO3)2, Mo(NO3)3, Mo(NO3)4, Mo(NO3)6 |
Tc | Ru(NO3)3 | Rh(NO3)3 | Pd(NO3)2, Pd(NO3)4 |
AgNO3, Ag(NO3)2 |
Cd(NO3)2 | In(NO3)3 | Sn(NO3)2, Sn(NO3)4 |
Sb(NO3)3 | Te | INO3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4, HfO(NO3)2 |
Ta | W(NO3)6 | ReO3NO3 | Os(NO3)2 | Ir3O(NO3)10 | Pt(NO3)2, Pt(NO3)4 |
HAu(NO3)4 | Hg2(NO3)2, Hg(NO3)2 |
TlNO3, Tl(NO3)3 |
Pb(NO3)2 | Bi(NO3)3, BiO(NO3) |
Po(NO3)2, Po(NO3)4 |
At | Rn | |
| FrNO3 | Ra(NO3)2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3, Ce(NO3)4 |
Pr(NO3)3 | Nd(NO3)3 | Pm(NO3)2, Pm(NO3)3 |
Sm(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | Ho(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | Lu(NO3)3 | |||
| Ac(NO3)3 | Th(NO3)4 | PaO(NO3)3 | U(NO3)4, UO2(NO3)2 |
Np(NO3)4 | Pu(NO3)4, PuO2(NO3)2 |
Am(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf(NO3)3 | Es | Fm | Md | No | Lr | |||
