Clorur d'hidrogen
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 35,976677 Da |
| Trobat en el tàxon | |
| Estructura química | |
| Fórmula química | HCl |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Velocitat del so | 296 m/s (0 °C, gas) |
| Solubilitat | 67 g/100 g (aigua, 30 °C) |
| Punt de fusió | −114 °C |
| Punt d'ebullició | −85 °C (a 760 Torr) |
| Entropia molar estàndard | 186,9 J/(mol K) |
| Pressió de vapor | 40,5 atm (a 20 °C) |
| Perill | |
| Límit d'exposició sostre | 7 mg/m³ (Estats Units d'Amèrica) |
| IDLH | 74,5 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
El clorur d'hidrogen és un compost covalent format per molècules diatòmiques amb un àtom d'hidrogen i un de clor, de fórmula , que a temperatura ambient es troba en estat gasós. La seva dissolució aquosa, anomenada àcid clorhídric, és molt emprada en els laboratoris i en la indústria.
Història
La dissolució aquosa de clorur d'hidrogen en aigua, l'àcid clorhídric, es coneixia des de temps antics. L'alquimista àrab Jàbir ibn Hayyan (721?-815), conegut per Geber a Europa, n'obtingué mesclant sal marina (clorur de sodi) amb oli de vidriol (àcid sulfúric). Els alquimistes europeus l'empraven i el coneixien per esperit de sal.[1][2]
Però l'aïllament del clorur d'hidrogen pur en forma de gas no es produí fins al 1774 per part del científic anglès Joseph Priestley per escalfament d'àcid clorhídric, anomenat àcid muriàtic o àcid marí. Posteriorment el mateix Priestley descobrí que també es podia sintetitzar per reacció del clorur de sodi amb àcid sulfúric.[3] El 1809 l'anglès John Dalton descobrí que una mescla de clor i hidrogen reaccionaven explosivament en exposar-se a la llum solar.[4] La seva composició fou estudiada el 1809 pels francesos Joseph-Louis Gay-Lussac i Louis Jacques Thénard i varen concloure que estava combinat amb aigua.[5] El químic anglès Humphry Davy demostrà el 1810[6] que en la seva composició no hi havia oxigen, malgrat ser un àcid, la qual cosa acabà amb la teoria dels àcids de Antoine Lavoisier.[1]
Estructura

La longitud de l'enllaç covalent σ és d'1,274 Å, major que la de l'enllaç (0,92 Å) i menor que la de l'enllaç (1,41 Å). Té una entalpia de dissociació de 428,13 kJ/mol,[7] inferior a la de l'enllaç (567 kJ/mol) i superior a la de l'enllaç (366 kJ/mol). La diferència d'electronegativitats és prou significativa, el clor és més electronegatiu que l'hidrogen (3,2 en front a 2,2) i atreu cap a ell la parella d'electrons que formen l'enllaç σ, de manera que la molècula té naturalesa polar, amb una major densitat de càrrega elèctrica negativa en el . El moment dipolar té un valor d'1,08 D,[8] inferior al de l'enllaç (1,82 D) i superior al de l'enllaç (0,82 D).
Propietats
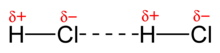
A temperatura ambient el clorur d'hidrogen és un gas incolor, amb una olor picant detectable a partir d'unes 0,8 ppm (mg/l),[9] que pot ser fàcilment condensat mitjançant un augment de pressió. En estat líquid també és incolor. A pressió atmosfèrica el gas condensa a –85,05 °C i el líquid congela a –114,22 °C. En estat sòlid s'estableixen interaccions elèctriques entre els àtoms de i de de molècules veïnes degut a la diferent densitat de càrrega elèctrica que presenten (interacció dipol-dipol), donant lloc a una disposició en ziga-zaga de les molècules.[7]

A la naturalesa es troba lliure en alguns gasos volcànics, com ara els dels volcans Kilauea (Hawaii), Popocatépetl (Mèxic), Villarrica (Xile) o Masaya, (Nicaragua). També se'l troba dissolt en l'aigua dels rius propers a aquests volcans. Les concentracions típiques dels fums volcànics oscil·len entre 0,1 i 3 ppm. Ràpidament el clorur d'hidrogen gas es dilueix en el vapor d'aigua i la seva vida no supera els 4 dies.[9] També dissolt es troba en el suc gàstric en una concentració del 0,2 al 0,4 % en els humans, i del 3 % en els cans. És un gas estable però es troba lleugerament dissociat en hidrogen i clor a altes temperatures (a 1537 °C només el 0,274 %, i a 1727 °C el 0,41 %). La descomposició es veu activada per efecte de guspires elèctriques, llum ultraviolada i radioactivitat.[4]
És soluble en etanol, metanol i èter, i té una elevada solubilitat en aigua, a 0 °C un litre d'aigua dissol 507 l de clorur d'hidrogen mesurat a la pressió atmosfèrica, que equival a uns 20 mols o a una proporció molar d'1:3. La concentració d'aquesta dissolució és del 45,4 % en massa. En refredar-se aquesta dissolució a –70 °C cristal·litza l'hexahidrat, . A d'altres concentracions cristal·litzen altres hidrats: el trihidrat a –24,9 °C; el dihidrat a –17,6 °C i el monohidrat a –15,3 °C.[7] A la concentració del 20,2 % forma una mescla azeotròpica o de punt d'ebullició constant, que bull a 108,6 °C a la pressió atmosfèrica normal.[10]
En dissolució aquosa es dissocia en el catió oxoni, , i l'anió clorur, , essent completa en dissolucions diluïdes:
Per aquesta raó les seves dissolucions, anomenades àcid clorhídric, tenen característiques d'àcid molt fort.[7] Les dissolucions concentrades desprenen gas, produint una característica boira deguda a la condensació del vapor d'aigua present a l'aire sobre les molècules d'.[10]

Amb l'amoníac, , també gas, reacciona directament en estat gasós donant lloc a un nigul blanc de clorur d'amoni, , que és sòlid:[10]
No reacciona amb el zinc, però és suficient que hi hagi una petita quantitat d'aigua perquè s'inicia la reacció amb formació d'hidrogen, , i clorur de zinc, . Amb els metalls més actius pot reaccionar en calent, és el mètode que s'empra quan se'ls vol obtenir anhidres. Per exemple amb el ferro i l'alumini s'obté clorur de ferro(II) i clorur d'alumini anhidres, juntament amb hidrogen gas:[10]
Preparació
El clorur d'hidrogen es pot obtindre molt pur fent reaccionar els elements hidrogen i clor, . Ambdós gasos s'obtenen com a subproductes en la producció d'hidròxid de sodi per electròlisi d'una dissolució de clorur de sodi. La síntesi d' es duu a terme cremant clor en excés d'hidrogen o de gas natural en cremadors especials. És una reacció exotèrmica amb una entalpia , que es produeix espontàniament de forma explosiva en presència de llum:
Un altre mètode d'obtenció és per reacció de clorur de sodi, , o clorur d'amoni, , amb àcid sulfúric concentrat, , a altes temperatures. És el procés més habitual als laboratoris, malgrat també s'empra de forma industrial. Té lloc en dues etapes:
També el clorur d'hidrogen s'obté com a subproducte en les reaccions de cloració de composts orgànics, mitjançant clor:[7]
Aplicacions
En la indústria química s'empra en processos d'hidrocloració i oxihidrocloració, que condueixen a la síntesi de polímeres sintètics com ara el PVC i els elastòmers clorats com el neoprè. També s'empra en la preparació de dissolvents clorats i altres productes d'interès industrial.[11] En electrònica també s'empra clorur d'hidrogen d'alta puresa (99,9944 %) s'empra en la producció de semiconductors.[12] En la indústria tèxtil s'empra per descompondre les fibres vegetals en la recuperació de la llana després de teixir-la i per desinfectar i netejar les llavors de cotó.[12] En la indústria dels metalls l'atmosfera de clorur d'hidrogen s'empra en la fabricació d'acer.[12] En la indústria petroliera s'empra en la producció de triclorur d'alumini, un catalitzador que s'utilitza per transformar el butà en isobutà.
Referències
- ↑ 1,0 1,1 Fernandes, Raymond. Chemistry 10 (en anglès). Ratna Sagar. ISBN 9788183323796.
- ↑ Datta, N. C.. The Story of Chemistry (en anglès). Universities Press, 2005. ISBN 9788173715303.
- ↑ Shakhashiri, Bassam Z. Chemical Demonstrations: A Handbook for Teachers of Chemistry (en anglès). Univ of Wisconsin Press, 1983. ISBN 9780299101305.
- ↑ 4,0 4,1 4,2 Partington, J.R.. Química General e Inorgánica (en castellà). 1a edició. Madrid: Tecnos, 1950, p. 952-953.
- ↑ Gay-Lussac, L.J.; Thénard, L.J. «De la nature et des propriétes de l'acide muriatique et de l'acide muriatique oxigéné». Mémoires de physique et de chimie, de la Société d'Arcueil, 1809, pàg. 339-358.
- ↑ Davy, H. «Researches on the Oxymuriatic Acid, Its Nature and Combinations; And on the Elements of the Muriatic Acid. With Some Experiments on Sulphur and Phosphorus, Made in the Laboratory of the Royal Institution». Phil. Trans., 100, 1810, pàg. 231-257.
- ↑ 7,0 7,1 7,2 7,3 7,4 Wiberg, Egon; Wiberg, Nils. Inorganic Chemistry (en anglès). Academic Press, 2001. ISBN 9780123526519.
- ↑ Ebbing, Darrell; Gammon, Steven D. General Chemistry (en anglès). Cengage Learning, 2016. ISBN 9781305887299.
- ↑ 9,0 9,1 The International Volcanic Health Hazard Network. «Hydrogen Chloride (HCl)» (en anglès). [Consulta: 17 novembre 2017].
- ↑ 10,0 10,1 10,2 10,3 Babor, J.; Ibarz, J. Química general Moderna (en castellà). 8a. Barcelona: Marín, 1979, p. 557-558. ISBN 8471029979.
- ↑ José, CASELLES POMARES María; Rosa, GÓMEZ ANTÓN María; Mariano, MOLERO MENESES; Jesús, SARDÁ HOYO. QUÍMICA APLICADA A LA INGENIERÍA (en castellà). Editorial UNED, 2015-04-24. ISBN 9788436270310.
- ↑ 12,0 12,1 12,2 Association, Compressed Gas. Handbook of Compressed Gases (en anglès). Springer Science & Business Media, 2012-12-06. ISBN 9781461306733.


























![{\displaystyle {\ce {NaCl\;+\;H2SO4\;->[200\;{}^{\circ }C]\;HCl\;+\;NaHSO4}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd05c6bbafb65b139ae587f82cafa0d6d99a0457)
![{\displaystyle {\ce {NaCl\;+\;NaHSO4\;->[800\;{}^{\circ }C]\;HCl\;+\;Na2SO4}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d57227acc465dedabe39f8fc6ad5062f891406a0)

