Química física
La química física[1] o la fisicoquímica[2] és una branca de la química que estudia els conceptes de la química des d'un punt de vista físic.[3] Els estudis del comportament i de les propietats dels sistemes químics des d'una perspectiva de la física es poden abordar tant a escala macroscòpica com a escala microscòpica, en aquest darrer cas a nivell molecular.[4]
La física química és una branca on hi ha una combinació de diverses disciplines, com la termodinàmica, l'electroquímica i la mecànica quàntica on les funcions matemàtiques poden representar interpretacions a nivell molecular i a nivell atòmic. Canvis en la temperatura, pressió, volum, calor i treball als sistemes, sòlid, líquid i/o gasós es troben també relacionats a aquestes interpretacions d'interaccions moleculars.
La química física moderna té fermes bases en la física pura. Àrees d'estudi molt importants en aquesta inclouen a la termoquímica (termodinàmica química), cinètica química, química quàntica, mecànica estadística, electroquímica, química de l'estat líquid, química col·loidal, química de superfícies i espectroscòpia. La química física forma part fonamental en l'estudi de la ciència de materials.
Història

La química física no es va constituir com a especialitat independent de la química fins a finals del segle xix. El terme "química física" va ser encunyat pel científic rus Mikhaïl Lomonóssov, entre el 1752 i el 1756 va escriure i va presentar un cicle de conferències sobre una nova ciència que va titular "Un curs de veritable Química Física" (en rus: “Курс истинной физической химии”) que considerava com una ciència bàsica per a l'estudi de l'estructura de la matèria.[5]
La química física moderna es va originar entre les dècades del 1860 i la del 1880 gràcies als treballs sobre química termodinàmica, electròlits en solució i cinètica química entre altres matèries. Una fita clau va ser la publicació el 1876 de l'obra On the Equilibrium of Heterogeneous Substances[6] (Sobre l'equilibri de substàncies heterogènies) de Josiah Willard Gibbs. En aquest treball es va presentar per primer cop diverses de les pedres angulars de la química física, com els conceptes d'energia de Gibbs, de potencial químic o la regla de les fases de Gibbs. Altres fites importants que podem citar són l'encunyació el 1908 del terme entalpia, atribuït al premi Nobel de Física neerlandès Heike Kamerlingh Onnes,[7][8] o el coneixement dels processos macromoleculars.
Les primeres revistes científiques que es van dedicar a la nova disciplina van ser l'alemanya Zeitschrift für physicalische Chemie dirigida per Wolfgang Ostwald (1853-1932) i Jacobus Henricus Van't Hoff (1852-1911), que va començar la seva publicació el 1887, i la nord-americana Journal of Physical Chemistry dirigida per Wilder Dwight Bancroft (1867-1953) publicada des de 1896. Malgrat això, durant tot el segle xix es van realitzar notables aportacions a alguns dels camps que habitualment solen reunir-se sota la química física, tals com l'electroquímica, la termoquímica o la cinètica química.
L'obra d'Alessandro Volta (1745-1827), especialment la pila que duu el seu nom, va ser el punt de partida de molts treballs en els quals es va estudiar els efectes de l'electricitat sobre els compostos químics. A principis del segle xix, Humphry Davy (1778-1829) va fer passar un corrent elèctric a través de solucions de sals, cosa que li va permetre de separar i estudiar dos nous metalls: el sodi i el potassi. El seu principal deixeble i el seu successor a la Royal Institution va ser Michael Faraday (1791-1867), que va continuar les investigacions del seu mestre. En un article publicat el 1834, Faraday va proposar les seves dues lleis sobre l'electròlisi. La primera afirma que la quantitat de substància que es diposita en un elèctrode és proporcional a la quantitat de càrrega elèctrica que travessa el circuit. A la segona llei, Faraday afirma que la quantitat de càrrega elèctrica que provoca el despreniment d'un gram d'hidrogen produeix el despreniment d'una quantitat igual a l'equivalent electroquímic d'altres substàncies.
Els treballs realitzats per Antoine Lavoisier (1743-1794) i Pierre-Simon Laplace (1749-1827) són habitualment considerats com el punt de partida de la termoquímica. Van dissenyar un nou instrument, el calorímetre, amb el qual podien realitzar mesures sobre la quantitat de calor despresa durant les reaccions químiques. Laplace i Lavoisier pensaven que el calòric era un dels elements imponderables i que els gasos eren compostos per calor i l'element corresponent. Durant la primera meitat del segle xix, la idea del calòric va ser abandonada i van començar a realitzar-se les investigacions que van permetre l'establiment de les lleis de la termodinàmica. L'aplicació d'aquestes investigacions als processos químics va permetre el sorgiment de la termoquímica, gràcies a l'obra d'autors com Marcellin Berthelot (1827-1907) o Henry Li Châtelier (1850-1936).
Un dels primers treballs dedicats a l'estudi de la cinètica química van ser les investigacions de Ludwig Ferdinand Wilhelmy (1812-1864) sobre la velocitat de canvi de configuració de determinats sucres en presència d'un àcid. A mitjan segle xix, Wilhelmy va arribar a la conclusió que la velocitat del canvi era proporcional a la concentració de sucre i d'àcid i que també variava amb la temperatura. La col·laboració entre un químic, George Vernon Harcourt (1834-1919), i un matemàtic, William Esson (1838-1916), va permetre la introducció d'equacions diferencials a l'estudi de la cinètica química. Esson va ser l'introductor de conceptes com els de reaccions de "primer ordre", la velocitat de les quals és proporcional a la concentració de només un reactiu, i de reaccions de "segon ordre", a les quals la velocitat és proporcional al producte de dues concentracions. En els darrers anys del segle xix, els treballs de Jacobus Henricus van 't Hoff (1852-1911), premi Nobel de Química del 1901, van tenir una gran influència en aquest i en altres camps de la química. Entre les seves aportacions, es troba la introducció del "mètode diferencial" per a l'estudi de la velocitat de les reaccions químiques i la seva famosa equació que permet relacionar la velocitat i la temperatura d'una reacció.
El desenvolupament de la mecànica quàntica i la seva aplicació a l'estudi dels fenòmens químics ha estat un dels canvis més notables que s'han produït en la química del segle xx. Entre els científics que més aportacions han realitzat en aquest sentit es troba Linus Pauling, autor de llibres tan significatius com el seu Introduction to Quantum Mechanics, with Applications to Chemistry (1935) o The Nature of the Chemical Bond and the Structure of Molecules and Crystals (1939). Entre moltes altres aportacions, Linus Pauling va ser l'introductor del nostre concepte modern d'electronegativitat.
Conceptes clau
Els conceptes fonamentals de la química física són les formes en què s'aplica la física pura als problemes químics.
Un dels conceptes clau en la química clàssica és que tots els compostos químics es poden descriure com a grups d'àtoms enllaçats i les reaccions químiques es poden descriure com la connexió i desconnexió d'aquests enllaços. La predicció de les propietats dels compostos químics a partir d'una descripció dels àtoms i com s'enllacen és un dels principals objectius de la química física. Per descriure els àtoms i enllaços amb precisió, cal conèixer tant on són els nuclis dels àtoms són, i com es distribueixen els electrons al voltant d'ells[9]
La química quàntica, un subcamp de la química física, especialment preocupat per l'aplicació de la mecànica quàntica als problemes químics, proporciona eines per determinar com són de forts i quina forma tenen els enllaços,[9] com es mouen els nuclis, i com la llum pot ser absorbida o emesa per un compost químic.[10] L'espectroscòpia és una subdisciplina relacionada de la química física, que es refereix específicament a la interacció de la radiació electromagnètica amb la matèria.
Una altra sèrie de qüestions importants de les quals s'ocupa la química són quins tipus de reaccions poden ocórrer de forma espontània i quines propietats són possibles per a un compost químic determinat. Això s'estudia a la termodinàmica química, que estableix límits a les quantitats com en quina mesura es pot produir una reacció, o quina quantitat d'energia es pot convertir en treball en un motor de combustió i que proporciona enllaços entre propietats com el coeficient d'expansió tèrmica i el canvi de la relació entre entropia amb la pressió d'un gas o líquid.[11] Amb freqüència es pot utilitzar per avaluar si és factible un disseny de reactor o motor, o per comprovar la validesa de les dades experimentals. Fins a cert punt, el quasi-equilibri i la termodinàmica del no equilibri poden descriure canvis irreversibles[12] No obstant això, la termodinàmica clàssica es refereix principalment als sistemes d'equilibri i canvis reversibles i no al que realment passa, o com passa de ràpid, més enllà de l'equilibri.
Quines reaccions es produeixen i amb quina velocitat s'esdeven és el tema de la cinètica química, una altra branca de la química física. Una idea clau en la cinètica química és que per tal que un reactiu reaccioni i formi productes, la majoria de les espècies químiques han de passar per un estat de transició, que són més alts en energia que qualsevol dels reactius o els productes que es fan servir com a barrera per a la reacció.[13] En general, com més gran és la barrera, més lenta serà la reacció. Una segona idea és que la majoria de les reaccions químiques es produeixen com una seqüència de reacció elemental,[14] cadascuna amb el seu estat de transició. Les qüestions clau en la cinètica inclouen en quina la velocitat de reacció depèn de la temperatura i de les concentracions de reactius i catalitzadors en la mescla de reacció, així com en quina forma poden ser dissenyats els catalitzadors i les condicions de reacció per optimitzar la velocitat de reacció.
La velocitat a què es produeixen les reaccions es pot especificar sovint només amb unes poques concentracions i una temperatura, en lloc d'haver de conèixer totes les posicions i velocitats de totes les molècules en una barreja; és un cas especial d'un altre concepte clau en la química física, que és en quina mesura necessita saber un enginyer. Tot el que succeeix en una barreja de milions de milions de milions de partícules sovint poden ser descrits per només unes poques variables com la pressió, la temperatura i la concentració. Les raons exactes d'això es descriuen a la mecànica estadística,[15] una especialitat dins de la química física que també és compartida amb la física. La mecànica estadística també proporciona formes de predir les propietats que veiem en la vida quotidiana de les propietats moleculars sense dependre de correlacions empíriques basades en similituds químiques.[12]
Seccions de la química física
Química col·loidal
La química col·loidal (del grec, κόλλα) és el nom tradicional de la química física de sistemes dispersos i fenòmens superficials que es produeixen a la interfície.[16] S'estudia l'adhesió, l'adsorció, la humectació, la coagulació, l'electroforesi i el desenvolupament de tecnologies de materials de construcció, els estris de perforació, el procés de sol-gel. La química col·loidal moderna és una ciència que es troba en el punt d'interacció entre la química, la física i la biologia.
Les principals tendències de la química col·loidal moderna són:
- La termodinàmica dels fenòmens de superfície.
- Estudi de l'adsorció del tensioactiu.
- Estudi de la formació i l'estabilitat dels sistemes dispersos, les seves propietats cineticomolecular, òptiques i elèctriques.
- Mecànica físico-química d'estructures disperses.
- Desenvolupament de la teoria i els mecanismes moleculars dels processos que ocorren en els sistemes dispersos sota la influència dels agents tensioactius, les càrregues elèctriques, resistència mecànica, etc.
Química del cristall
És la ciència de les estructures cristal·lines i la seva relació amb la naturalesa de la matèria.[17] Com una branca de la química, la química del cristall està estretament relacionada amb els estudis de cristal·lografia i la disposició espacial dels àtoms i els enllaços químics en els cristalls, així com la dependència de les propietats físiques i químiques de les substàncies cristal·lines en la seva estructura. Amb l'ajuda de la difracció de raigs X, de la difracció d'electrons i neutrons, i de la difracció cristal·lina estructural, determinar els valors absoluts de les distàncies interatòmiques i els angles entre les línies d'enllaços químics (angles d'enllaç). Aquesta secció de la química té abundant material sobre les estructures cristal·lines de més de 425.000 compostos, més de la meitat dels quals són compostos inorgànics.
Els objectius de la química del cristall són:
- taxonomia i la descripció de les estructures cristal·lines observades en aquests tipus d'enllaços químics;
- interpretació de les estructures cristal·lines (identificació dels factors que determinen l'estructura d'un material cristal·lí) i la predicció;
- estudi de les propietats físiques i químiques dels vidres amb la seva estructura i la naturalesa de l'enllaç químic.
Radioquímica
La radioquímica és la part de la química física que treballa amb petites quantitats de substàncies, en solucions molt diluïdes, de fonts de radiació ionitzant.[18] La radioactivitat dels compostos estudiats pot ser radioquímica i requereix l'ús de mètodes altament sensibles i específics per a mesurar les seves quantitats microscòpiques, amb mètodes d'anàlisi automatitzats.
Termoquímica

És una secció de la química, que té com a missió els següents punts:
- Identificar i estudiar els efectes tèrmics de les reaccions.
- L'establiment de les seves relacions amb els diversos paràmetres fisicoquímics.
- Mesurar l'escalfament de substàncies i l'establiment de la seva calor de transicions de fase.
Subsecció sobre l'estructura de l'àtom
Aquesta disciplina s'encarrega de l'estudi de les partícules microscòpiques de la matèria i la massa, la part més petita d'un element químic, que és el portador de les seves propietats: l'àtom. Un àtom consta d'un nucli i electrons. Si el nombre de protons en el nucli és igual al nombre d'electrons en un àtom és elèctricament neutre en general. En cas contrari, té part de càrrega positiva o negativa. En alguns casos, per àtoms elèctricament neutres només entendre el sistema en què la càrrega del nucli és igual a la càrrega total dels electrons, el que els contrast amb els ions carregats elèctricament.
Subsecció sobre la corrosió de metalls

En aquesta part de la química física s'estudia la corrosió dels metalls per interacció química o fisicoquímica amb el medi ambient.[19] La causa de la corrosió és la inestabilitat termodinàmica dels materials de construcció als efectes de les substàncies que estan en contacte amb el seu entorn. En la vida quotidiana, els aliatges de ferro (acer) sovint fan servir el terme "plaga". Els casos menys coneguts de la corrosió dels polímers. Pel que fa a ells hi ha el concepte de l'"envelliment", similar al terme "corrosió" per als metalls. La velocitat de corrosió, així com qualsevol reacció química és altament dependent de la temperatura. L'augment de la temperatura a 100 °C pot augmentar la velocitat de corrosió en diversos ordres.
Subsecció de les solucions
Aquesta subsecció estudia les solucions, una barreja homogènia que consisteix en partícules de productes de solut, dissolvent i de la seva interacció. La formació d'un tipus particular de solució es determina per la intensitat de la intermolecular interatòmica, o un altre tipus d'interacció de ions de liti, és a dir, les mateixes forces que determinen l'aparició d'un estat particular de l'agregació.
Les diferències: la formació d'una solució depèn de la naturalesa i la intensitat de la interacció entre les partícules de diferents substàncies.
Les solucions són gasos, líquids i sòlids.
Química cinètica
La cinètica de les reaccions químiques és la part de la química física, que s'encarrega de l'estudi de les lleis de les reaccions químiques en el temps, en funció de les lleis del medi ambient extern, com també els mecanismes de les reaccions.[20]
Fotoquímica
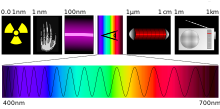
Part de la química d'altes energies, és la secció de la química física que estudia les reaccions químiques (química dels estats excitats de molècules, reaccions fotoquímiques) que es produeixen sota la influència de la llum en el rang des de l'ultraviolat fins a l'infraroig. Molts dels processos més importants del medi ambient i nosaltres tenen una naturalesa fotoquímica. Només cal esmentar coses com la fotosíntesi, els ulls i l'ozó i la irradiació UV.
Lleis de la fotoquímica:
- Canvis fotoquímics es produeixen només sota l'acció de la llum absorbida pel sistema.
- Cada fotó és absorbit en l'acte primari és capaç d'activar una sola molècula.
- L'absorció d'un fotó de cada molècula té una certa probabilitat de la liquidació o de la samarreta més baix (amb multiplicitat 1) de l'estat o del triplet més baix (amb multiplicitat 3) d'estat.
- La majoria dels processos fotoquímics orgànics en solució intervenir, ni el primer estat singlet excitat, o el primer estat excitat triplet.
Químics físics destacats
- Michael Gómez
- Svante Arrhenius
- Peter Debye
- Erich Hückel
- Josiah W. Gibbs
- J.H. van 't Hoff
- Lars Onsager
- Wilhelm Ostwald
- Linus Pauling
Revistes
Algunes revistes que s'ocupen de la química física inclouen:
- Zeitschrift für Physikalische Chemie (1887)
- Journal of Physical Chemistry A (des de 1896 com a Journal of Physical Chemistry, redenominada el 1997)
- Physical Chemistry Chemical Physics (des de 1999, anteriorment Faraday Transactions amb una història que es remunta a 1905)
- Macromolecular Chemistry and Physics (1947)
- Annual Review of Physical Chemistry (1950)
- Molecular Physics (1957)
- Journal of Physical Organic Chemistry (1988)
- Journal of Physical Chemistry B (1997)
- ChemPhysChem (2000)
- Journal of Physical Chemistry C (2007)
- Journal of Physical Chemistry Letters (des de 2010, cartes combinades prèviament publicats en les revistes independents)
Les revistes històriques que cobrien la química i la física inclouen Annales de Chimie et de physique (iniciada el 1789, publicada sota el nom donat aquí 1815-1914).
Referències
- ↑ Error en el títol o la url.«». Cercaterm. TERMCAT. [Consulta: 5 febrer 2022].
- ↑ «Físicoquímica». Diccionari de la llengua catalana. Institut d'Estudis Catalans. [Consulta: 4 febrer 2012].
- ↑ «Química física». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Levine, 2008, p. 1.
- ↑ Vucinich, Alexander. «Science in the age of crisis, 1884-1917. Modern Physics and Chemistry». A: Science in Russian Culture: 1861-1917 (en anglès). Stanford University Press, 1970, pàg. 388. ISBN 0804707383 [Consulta: 4 febrer 2012]. «In the 1880's Russia already had a long but tenuous tradition in physical chemistry. In 1752-56, Lomonosov wrote and lectured on a new science, which he named “physical chemistry” and identified as the primary science for studying the structure of matter.»
- ↑ Gibbs, Josiah Willard. «On the Equilibrium of Heterogeneous Substances» (en anglès). Massachusetts Institute of Technology, 1876. Arxivat de l'original el 2012-10-26. [Consulta: 4 febrer 2012].
- ↑ Helrich, Carl S. Modern thermodynamics with statistical mechanics (en anglès). Springer, 2009, pàg. 64. ISBN 3540854177 [Consulta: 4 febrer 2012]. «The Dutch physicist ans discoverer of superconductivity, Heike Kamerlingh Onnes, initially introduces the term enthalpy at the first meeting of the institute of Refrigeration in Paris in 1908. He had derived the name enthalpy from Greek word “enthalpos” (ἔνθαλπος).»
- ↑ Trsic, Milan; Evelyn Jeniffer De Lima Toledo. «Chemical Transformations and Reactions: Velocity and energy Balance». A: A Serious Glance at Chemistry: Basic Notions Explained (en anglès). World Scientific, 2010, pàg. 109. ISBN 1848165307 [Consulta: 4 febrer 2012]. «Josiah Willard Gibbs (America, 1839-1903) introduced the “head function at constant pressure” in 1875. Other scientists defined the modern term enthalpy later. The thermodynamic potential (enthalpy) was defined by the Dutch physicist Heike Kamerlingh Onnes (1853-1926) in the early 20th century.»
- ↑ 9,0 9,1 Atkins, Peter and Friedman, Ronald (2005). Molecular Quantum Mechanics, p. 249. Oxford University Press, New York. ISBN 0-19-927498-3
- ↑ Atkins, Peter i Friedman, Ronald (2005). Molecular Quantum Mechanics, p. 342. Oxford University Press, New York. ISBN 0-19-927498-3
- ↑ Landau, L. D. i Lifshitz, E. M. (1980). Statistical Physics, 3rd Ed. p. 52. Elsevier Butterworth Heinemann, New York. ISBN 0-7506-3372-7
- ↑ 12,0 12,1 Hill, Terrell L. (1986). Introduction to Statistical Thermodynamics, p. 1. Dover Publications, New York. ISBN 0-486-65242-4
- ↑ Schmidt, Lanny D. (2005). The Engineering of Chemical Reactions, 2a ed. p. 30. Oxford University Press, New York. ISBN 0-19-516925-5
- ↑ Schmidt, Lanny D. (2005). The Engineering of Chemical Reactions, 2a. ed. p. 25, 32. Oxford University Press, New York. ISBN 0-19-516925-5
- ↑ Chandler, David (1987). Introduction to Modern Statistical Mechanics, p. 54. Oxford University Press, New York. ISBN 978-0-19-504277-1
- ↑ Захарченко В. Н.. Коллоидная химия: Учеб. для для медико-биолог. спец. вузов. (en rus). 2a edició, 1989, p. 238.
- ↑ Бокий Г. Б.. Кристаллохимия (en rus). Moscou: Moscow State University Press, 1960, p. 357.
- ↑ Несмеянов А. Н., Радиохимия, М., 1972.
- ↑ Бриккер Ю., Меньшиков Ю.. «Коррозия металлов, способы защиты от нее». Учебный фильм для ВУЗов. Центрнаучфильм, 1980. [Consulta: 18 març 2013].
- ↑ КИНЕТИКА ХИМИЧЕСКАЯ — химическая энциклопедия
Bibliografia
- Levine, Ira N. Physical Chemistry (en anglès). Sisena edició. McGraw-Hill, 2008. ISBN 978–0–07–253862–5.
- P.W. Atkins. Physical Chemistry. Oxford University Press, 1978. ISBN 0-7167-3539-3.
- R.J. Hunter. Introduction to Modern Colloid Science. Oxford University Press, 1993. ISBN 0-19-855386-2.
- M. Díaz Peña, A. Roig Muntaner. Química Física. Alhambra. Madrid, 1984. ISBN 84-205-0569-2.
- J. Bertran Rusca, J. Núñez Prim. Química Física. Ariel, Barcelona, 2002. ISBN 84-344-8050-6.
- Laidler, K.J.. The World of Physical Chemistry. University Press, Oxford, 1993.
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Química física |
- Joachim Schummer. The Autonomy of Chemistry. Physical Chemistry: neither Fish nor Fowl? (en anglès). Würzburg: Königshausen & Neumann, 1998.
- Mary Jo Nye. «The Cambridge History of Science: The modern physical and mathematical sciences» (en anglès), 2003.