Ρόδιο
| Ρόδιο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Ρόδιο (Rh) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | στοιχείο μετάπτωσης | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
9 ,5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
102,90550 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
[Kr] 4d85s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-125-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7440-16-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 142±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 2,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
+3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η: 719,7 kJ/mol 2η: 1740 ΚJ/mol 3η: 2997 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό πλέγμα | ολοεδρικά κεντρωμένο | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | 1964 °C (3567 °F) (2237 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | 3695 °C (6683 °F) (3968 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | (20 °C)12,41 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 26,59 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 494 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 24,98 J/mol·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | παραμαγνητικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αντίσταση |
49 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική ηλεκτρική αγωγιμότητα | 20,41 MS/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
(27 °C) 152 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Mohs | 6,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Vickers | 1246 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σκληρότητα Brinell | 1100 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας (Young's modulus) |
380 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο διάτμησης (Shear modulus) |
150 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μέτρο ελαστικότητας όγκου (Bulk modulus) |
275 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Λόγος Poison | 0,26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | (20 °C) 4700 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Το χημικό στοιχείο ρόδιο (αγγλικά: Rhοdium) είναι μέταλλο με ατομικό αριθμό 45 και σχετική ατομική μάζα 102,9055. Το χημικό του σύμβολο είναι «Rh» και ανήκει στην ομάδα 9 του περιοδικού πίνακα, στην περίοδο 5 και στο d-block, της 2ης κύριας σειράς των στοιχείων μετάπτωσης. Έχει θερμοκρασία τήξης 1964 °C και θερμοκρασία βρασμού 3695 °C.[1]
Το όνομα «ρόδιο» προέρχεται από την ελληνική λέξη «ρόδο» που σημαίνει τριαντάφυλλο, επειδή ορισμένα υδατικά διαλύματα αλάτων του έχουν ροζ χρώμα.
Από άποψη χημικής συμπεριφοράς, ανήκει στην «ομάδα του λευκόχρυσου», PGM, Platinum Group Metals ή PGE, Platinum Group Elements.
Το ρόδιο θεωρείται ευγενές μέταλλο μαζί με το ρουθήνιο, το ιρίδιο, το παλλάδιο, τον άργυρο, το όσμιο, το λευκόχρυσο και το χρυσό.
Ανακαλύφθηκε το 1803 από τον Άγγλο χημικό Γουόλλαστον στα κατάλοιπα επεξεργασίας μεταλλευμάτων λευκόχρυσου. Σήμερα εξάγεται μαζί με τα άλλα PGM από κοιτάσματα στη Νότια Αφρική, τη Ρωσία και τη Βόρεια Αμερική.
Είναι το σπανιότερο μη-ραδιενεργό χημικό στοιχείο στη γη[2] και αυτό με τη μεγαλύτερη αξία από όλα τα ευγενή μέταλλα: η τιμή του 1 Kg ήταν πάνω από 80.000 δολάρια στις αρχές του 2010.
Το ρόδιο χρησιμοποιείται κυρίως ως καταλύτης ενώ, εξαιτίας της σπανιότητάς του, κατεργάζεται συνήθως με τη μορφή κραμάτων με λευκόχρυσο ή παλλάδιο σε εφαρμογές όπου απαιτείται υψηλή θερμοκρασία και μεγάλη αντοχή στη διάβρωση. Ανιχνευτές ροδίου χρησιμοποιούνται στους πυρηνικούς αντιδραστήρες για τη μέτρηση της ροής νετρονίων.
Το ρόδιο έχει μόνο ένα σταθερό ισότοπο, το 103Rh.
Ιστορία
Το ρόδιο ανακαλύφθηκε το 1803[3]
από τον Άγγλο χημικό Ουίλλιαμ Χάιντ Γουόλλαστον (William Hyde Wollaston), λίγο μετά την ανακάλυψή του παλλαδίου[4] από τον ίδιο. Χρησιμοποήθηκε μετάλλευμα λευκόχρυσου προέλευσης, κατά πάσα πιθανότητα, Νότιας Αμερικής.[5]
Ο Γουόλλαστον διέλυσε το μετάλλευμα πλατίνας σε βασιλικό νερό, οπότε το μεγαλύτερο μέρος του λευκόχρυσου απομακρύνθηκε, με προσθήκη χλωριούχου αμμωνίου, NH4Cl, ως χλωριολευκοχρυσικό αμμώνιο, (NH4)2PtCl6. Στο διήθημα πρόσθεσε ψευδάργυρο, με αποτέλεσμα την καθίζηση των καταλοίπων της πλατίνας, ενός μέρους του παλλαδίου, του ροδίου, του χαλκού και του μολύβδου. Απομάκρυνε τα δύο τελευταία μέταλλα με διάλυση σε αραιό νιτρικό οξύ, ενώ διαλυτοποίησε τα άλλα με περισσότερο βασιλικό νερό. Μετά, πρόσθεσε χλωριούχο νάτριο και εξάτμισε το διάλυμα λαμβάνοντας έτσι κοκκινωπό ένυδρο χλωροροδικό νάτριο του τύπου Na3[RhCl6].12H2O.[6] Μετά το πλύσιμο με αιθανόλη, το κόκκινο ίζημα είχε αντιδράσει με τον ψευδάργυρο σχηματίζοντας μεταλλικό ρόδιο.[4]
Ο Γουόλλαστον κατέγραψε δύο βιομηχανικές εφαρμογές του ροδίου και παλλαδίου. Χρησιμοποιούσε ένα ανθεκτικό κράμα παλλαδίου-χρυσού για τα επιστημονικά του όργανα και ένα κράμα ροδίου-κασσιτέρου για να φτιάχνει μύτες για πένες μελανιού, οι οποίες στα 1820 πωλούνταν έξι πένες η μία. Το Μουσείο Επιστημών του Λονδίνου, διατηρεί ακόμη δείγματα από πένες ροδίου-κασσιτέρου του Γουόλλαστον.
Οι καταλυτικές ιδιότητες των PGM ανακαλύφθηκαν για πρώτη φορά από τον Χάμφρι Ντέιβι (Humphry Davy) αρχικά στην ετερογενή κατάλυση το 1817, με την πλατίνα.[4] Αργότερα, ο Θενάρ (The'nard) απέδειξε ότι σκόνη ροδίου-ιριδίου-παλλαδίου κατέλυε την αντίδραση υδρογόνου και οξυγόνου. Την ίδια εποχή, κατασκευάστηκαν και δύο ξυραφάκια από ρόδιο, ιρίδιο, ασημί και χάλυβα και προσφέρθηκαν στο Μάικλ Φαραντέι.[7]
Το 1908, ο Ουίλλιαμ Κρουκς (Sir William Crookes) έπεισε την εταιρεία Johnson Matthey να κατασκευάσει χωνευτήρια από ρόδιο, ιρίδιο, ρουθήνιο και όσμιο. Ο Crookes δεν κατέγραψε αν πέτυχαν οι κατασκευές με τα δύο τελευταία μέταλλα, αλλά βρήκε ότι το ρόδιο είναι σχεδόν το ίδιο ανθεκτικό υλικό, όπως το ιρίδιο.[4]
Σήμερα, η κατάλυση είναι το σημαντικότερο πεδίο χρήσης του ροδίου.
Εμφανίσεις - εξόρυξη - απομόνωση του μετάλλου

Η ετήσια παγκόσμια προμήθεια ροδίου το 2009 ήταν περίπου 22 τόννοι (719.000 ουγγιές) και η ζήτηση την ίδια χρονιά ήταν περίπου 15,5 τόννοι (542.000 ουγγιές).[8] Ενδεικτικά αναφέρεται ότι η παγκόσμια παραγωγή χρυσού από τα ορυχεία το 2007 ήταν περίπου 2.470 τόννοι.[9]
Εμφανίσεις
Τα PGM στη φύση ανευρίσκονται ως κράματα, κυρίως μεταξύ τους, με τη μορφή θειούχων ή αρσενικούχων ενώσεών τους, ως οξείδια ή υδροξείδια και πολύ σπάνια ως αυτοφυή μέταλλα. Τα κοιτάσματα των μετάλλων αυτών προέρχονται κυρίως από κλασματική κρυστάλλωση ρευστού μάγματος, συνυπάρχουν δε με κοιτάσματα χρωμίτη και αδάμαντα.
Οι σπουδαιότερες, οικονομικής σημασίας, συγκεντρώσεις των PGΜ, έχουν βρεθεί σε καθορισμένους στρωματογραφικούς ορίζοντες συμπλεγμάτων στρωματόμορφου τύπου:
- Σύμπλεγμα Bushveld[10] της Νότιας Αφρικής που είναι και ο μεγαλύτερος εξαγωγέας ροδίου (> 80%). Τα πετρώματα αυτά περιέχουν κατά μέσο όρο περίπου 7 % Rh.[11]
- Κοιτάσματα νικελίου -χαλκού-PGM της χερσονήσου Ταιμύρ (Taimyr) στο Νόριλσκ (Noril'sk) της Σιβηρίας και του Μόντσεγκορσκ (Monchegorsk) της χερσονήσου Κόλα κοντά στη Φινλανδία. Περιέχουν κατά μέσο όρο περίπου 3 % Rh.[11] Η Ρωσία είναι ο δεύτερος εξαγωγέας ροδίου στον κόσμο.
- Σύμπλεγμα Στιλλγουώτερ (Stillwater) της Νότιας Μοντάνα των Η.Π.Α. Η οικονομική εκμετάλλευση του συμπλέγματος άρχισε το 1987.[12]
| Περιβάλλον | ppb κατά βάρος |
ppb κατά άτομο |
|---|---|---|
| Σύμπαν | 0.6 | 0.007 |
| Ήλιος | 2 | 0.02 |
| Μετεωρίτες | 180 | 40 |
| Λιθόσφαιρα | 0.70 | 0.1 |
- Στη Λεκάνη Σάντμπερυ (Sudbury) του Οντάριο του Καναδά, μαζί με κοιτάσματα νικελίου. Επίσης στο Χωκ Ρίτζ (Hawk Ridge) καθώς και στη Μανιτόμπα (Manitoba).[14] Αν και η ποσότητα ροδίου που υπάρχει στο Sudbury είναι πολύ μικρή, η μεγάλη αξία των μεταλλευμάτων νικελίου καθιστά την ανάκτηση του ροδίου οικονομικά συμφέρουσα.[15]
- Στη Ζιμπάμπουε της Αφρικής στην περιοχή Γκρέιτ Ντάικ (Great Dyke)[10] έχουν εντοπιστεί υψηλά αποθέματα PGM (περίπου 8.000 τόννοι).[16]
Υπάρχουν όμως και ιζηματογενή κοιτάσματα PGM που έχουν προκύψει από την αποσάθρωση συνεκτικών πετρωμάτων και τη μεταφορά και απόθεση των υλικών σε άλλες θέσεις. Τέτοια κοιτάσματα έχουν εντοπιστεί στην περιοχή Τσόκο (Choco) της Κολομβίας, σε διάφορα ποτάμια του Καναδά και στο Βιτάτερσραντ (Witatersrant) της Ν. Αφρικής.
Εκτός από τις γεωλογικές εμφανίσεις των PGM, ικανοποιητικές ποσότητες ροδίου προσφέρει και η ανακύκλωση των ανενεργών καταλυτών των αυτοκινήτων. Η ανάκτηση του Rh από «δηλητηριασμένους» καταλύτες αυτοκινήτων γίνεται με διάφορες μεθόδους και κυμαίνεται από 65 % έως και 90 %.
Εξόρυξη
Ο χρόνος μεταξύ της εξόρυξης του μεταλλεύματος και της παραγωγή καθαρού ροδίου είναι συνήθως έως και 20 εβδομάδες.[12]
Τα PGM εξορύσσονται συνήθως από υπόγεια ορυχεία και σπάνια από επιφανειακές εμφανίσεις. Ο αρχικός τεμαχισμός των βράχων γίνεται από τους εργάτες των ορυχείων με κομπρεσέρ ή με εκρηκτικά. Μετά τη μεταφορά στην επιφάνεια με βαγονέτα των μεγάλων κομματιών από το υπόγειο ορυχείο, αυτά τεμαχίζονται σε πολύ μικρά κομμάτια, απομακρύνονται οι προσμίξεις, για να αποκαλυφθούν τα ορυκτά που περιέχουν τα επιθυμητά μέταλλα και τέλος αλέθονται μέχρι να γίνουν σκόνη. Σ' αυτή τη φάση, ένας τόννος μεταλλεύματος συνήθως περιέχει 4 έως 7 γραμμάρια μετάλλων.[17] Στη συνέχεια, με μια διαδικασία που ονομάζεται «επίπλευση αφρού», το μετάλλευμα αναμιγνύεται με νερό και χημικές ουσίες οπότε εμπλουτίζεται σε PGM, προσκολλάται στις φυσαλίδες που δημιουργούνται από τη διαδικασία, επιπλέει στην επιφάνεια και απομακρύνεται. Το εμπλουτισμένο μετάλλευμα περιέχει τώρα από 100 έως 1000 γραμμάρια μετάλλων ανά τόνο. Το υπόλοιπο υλικό περνάει από τη διαδικασία άλεσης και επίπλευσης για δεύτερη φορά. Τα τελικά κατάλοιπα-απόβλητα είτε επιστρέφονται στο ορυχείο για να κλείσουν τα ανοικτά σημεία εξόρυξης, είτε απορρίπτονται σε απομακρυσμένα σημεία στην επιφάνεια του εδάφους, είτε υποβάλλονται σε πρόσθετη επεξεργασία για την ανάκτηση των άλλων μετάλλων που υπάρχουν, όπως νικέλιο ή χαλκός. Εν τω μεταξύ, το μετάλλευμα το οποίο μετά το νέο εμπλουτισμό περιέχει 1400 γραμμάρια μετάλλων ανά τόνο, μεταφέρεται στο κοντινό εργοστάσιο για περαιτέρω επεξεργασία. Εκεί ξηραίνεται σε θερμοκρασίες που μπορεί να είναι πάνω από 1500 °C και διαχωρίζεται από ανεπιθύμητα ορυκτά όπως του σιδήρου και του θείου, τα οποία απομακρύνονται με διοχέτευση ρευμάτων αέρα. Η τελική περιεκτικότητα σε πολύτιμα μέταλλα αντιπροσωπεύει ένα πολύ μικρό ποσοστό της αρχικής μάζας του μεταλλεύματος. Για παράδειγμα, στο ορυχείο Stillwater των Η.Π.Α. από 850.000 τόννους πρωτογενούς μεταλλεύματος, θα παραχθούν τελικά σε ετήσια βάση μόνο 15,5 τόννοι εξευγενισμένων PGM[18]
Στο χυτήριο, το οποίο μπορεί να έχει μια ικανότητα επεξεργασίας έως και 100 τόνους/ημέρα, το μετάλλευμα κατεργάζεται σε ηλεκτρική κάμινο σε θερμοκρασίες κοντά στους 1600 °C για να απομακρυνθούν διάφορα άχρηστα υλικά και τελικά, μετά από διπλή επεξεργασία, προκύπτει μια «σκουριά» (matte) από PGM και άλλα μέταλλα. Το matte υφίσταται περαιτέρω επεξεργασία κατά την οποία τα βασικά μέταλλα, όπως ο χαλκός, το νικέλιο και το κοβάλτιο, απομακρύνονται οπότε απομένει ένα μίγμα λεπτόκοκκων PGM.
Διαχωρισμός και απομόνωση του ροδίου
Το τελικό βήμα στην παραγωγή είναι ο διαχωρισμός και ο καθαρισμός των PGM σε ξεχωριστά μέταλλα.[17] Αυτό είναι και το πιο δύσκολο κομμάτι της όλης διαδικασία και συνδυάζει χημικές μεθόδους, αποστάξεις και τεχνικές ανταλλαγής ιόντων. Η βασική διαδικασία σε γενικές γράμμες είναι η εξής: Στα μεταλλεύματα των PGM μπορεί να συνυπάρχουν και χρυσός (Au) ή/και άργυρος (Ag) που πρέπει επίσης να απομακρυνθούν. Το μίγμα μετάλλων κατεργάζεται με βασιλικό νερό στο οποίο διαλύονται ο λευκόχρυσος (Pt), το παλλάδιο (Pd) και ο Au. Τα άλλα μέταλλα δηλ. ρουθήνιο (Ru), όσμιο (Os), ρόδιο (Rh), ιρίδιο (Ir) και Ag μένουν ως αδιάλυτα χλωριούχα σύμπλοκα. Στη συνέχεια αυτά τα αδιάλυτα διαλύονται σε τήγμα μολύβδου (Pb) και νιτρικό οξύ (HNO3) οπότε απομακρύνεται ο Ag και ο Pb με μορφή νιτρικού αργύρου (AgNO3) και μολύβδου (PbNO3). Τα αδιάλυτα που απομένουν είναι τα μέταλλα Ru, Os, Rh, Ir. Ακολουθεί σύντηξη με όξινο θειικό νάτριο (ΝaHSO4) και διάλυση στο νερό, οπότε απομονώνεται το διαλυτό θειικό ρόδιο(ΙΙΙ), Rh2(SO4)3,[13] ενώ τα άλλα μέταλλα (Ru, Os, Ir) μένουν αδιάλυτα. Ακολουθεί προσθήκη υδροξειδίου του νατρίου (NaOH), οπότε σχηματίζεται υδροξείδιο του ροδίου(ΙΙΙ), Rh(OH)3, το οποίο επαναδιαλύεται σε υδροχλωρικό οξύ (HCl) και έτσι προκύπτει χλωροροδικό οξύ, H3RhCl6. Αυτό κατεργάζεται με νιτρώδες νάτριο (NaNO2) και χλωριούχο αμμώνιο (NH4Cl), οπότε καταβυθίζεται το σύμπλοκο (NH4)3[Rh(NO2)6]. Διάλυση του ιζήματος σε HCl δίνει διάλυμα καθαρού χλωροροδικού αμμωνίου, (NH4)3RhCl6.[19] Τέλος, γίνεται εξάτμιση μέχρι ξηρού και αντίδραση με αέριο υδρογόνο στους 1000 °C οπότε προκύπτει καθαρό ρόδιο κατά την αντίδραση: 2(NH4)3RhCl6 + 3H2 → 2Rh + 6NH4Cl + 6HCl
Το ρόδιο σε προϊόντα σχάσης
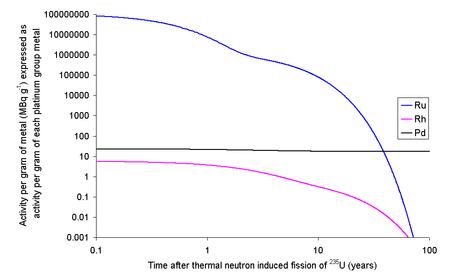
Ρόδιο επίσης μπορεί να απομονωθεί από πυρηνικά καύσιμα (κατάλοιπα)τα οποία δε μπορούν πλέον να συντηρήσουν τη σχάση και τα οποία περιέχουν περίπου 3 % w/w προϊόντα σχάσης του ουρανίου-235 με μέσο όρο 400 g ρόδιο σε κάθε τόνο τους. Το ρόδιο που παράγεται μ' αυτό τον τρόπο περιέχει το ραδιοϊσότοπο 102mRh με ημιζωή 2,9 χρόνια και επομένως πρέπει να αποθηκευτεί τουλάχιστον για 20 χρόνια σε ασφαλή περιοχή για να σταθεροποιηθεί και να μειωθεί στο ελάχιστο η επικινδυνότητά του λόγω εκπομπής ραδιοακτινοβολιών, επειδή κάθε 2,9 χρόνια η ραδιενέργεια που εκπέμπει μειώνεται κατά 50 %.
Σύμφωνα με τους κανόνες υγιεινής και ασφαλείας, κάθε ραδιοϊσότοπο που εκπέμπει περισσότερο από 1 Ci[Σημ. 2] είναι επικίνδυνο. Το ρόδιο που ανακτάται από τα πυρηνικά κατάλοιπα, εκπέμπει 8,1 Ci/g μετά από 5 χρόνια απομόνωσης αλλά μετά από 8 χρόνια η δραστηριότητα αυτή πέφτει στα 4,1 Ci, μετά από 11 χρόνια θα είναι 2,2 Ci, μετά από 14 χρόνια πέφτει στα 1,1 Ci, μετά από 17 χρόνια είναι 0,55 Ci και μετά από 20 χρόνια μόνο 0,27 Ci/g. Μετά από 30 χρόνια, η ραδιενέργεια αυτή μειώνεται στο 0,00027 Ci, το οποίο είναι πιο κάτω και από τα χαμηλότερα όρια των πιο αυστηρών κανόνων υγιεινής. Η ραδιενέργεια του ανακτημένου ροδίου μειώνεται τόσο γρήγορα επειδή το ποσοστό του 102mRh που περιέχει είναι πάρα πολύ μικρό (ίχνη περίπου 3,68×10−9 g/Kg ροδίου) και η υπόλοιπα ποσότητα του υλικού απορροφά την ακτινοβολία που απελευθερώνεται.
Με μια πρώτη ματιά, το ρόδιο που προέρχεται από την κατεργασία χρησιμοποιημένων πυρηνικών καυσίμων θα μπορούσε να αποτελέσει προστιθέμενη αξία της επανεπεξεργασίας των καταλοίπων της σχάσης, αλλά το κόστος διαχωρισμού του ροδίου από τα άλλα μέταλλα είναι μεγάλο.[20]
Οικονομικά στοιχεία
Το ρόδιο είναι το ακριβότερο μέταλλο. Η τιμή του στις 20 Φεβρουαρίου 2013 στις 8.00 το πρωί (ώρα Λονδίνου), ήταν 1.265 δολάρια/ουγγιά ή περίπου 30.670 ευρώ/Kg.[21]
Το πρώτο πεντάμηνο του 2010 ήταν περίπου 2.645 δολάρια/ουγγιά ενώ του λευκόχρυσου ήταν 1,6 φορές μικρότερο, του χρυσού 2,4 φορές μικρότερο και του αργύρου 150 φορές μικρότερο.
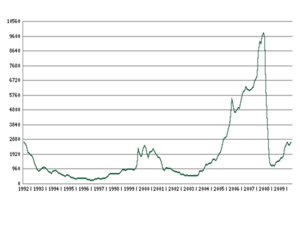
Η μέση τιμή του ροδίου από το 1992 έως και το 2004 δεν ξεπέρασε τα 940 δολάρια/ουγγιά, αλλά από το 2005 και μετά η τιμή έχει παρουσιάσει ανοδική πορεία και στις 19 Ιουνίου 2008 άγγιξε τα 10.100 δολάρια/ουγγιά.[21]
Από τον Ιούνιο του 2008 όμως, η οικονομική ύφεση ώθησε την τιμή του ροδίου απότομα προς τα κάτω και στις 3 Νοεμβρίου 2009 ήταν στα 1.950 δολάρια/ουγγιά, ωστόσο η τιμή ανέβηκε ξανά από τις αρχές του 2010.[21]
- Διακύμανση της τιμής του Rh 1992-2009 και τιμές ευγενών μετάλλων τον Ιανουάριο του 2010
-
Διακύμανση της τιμής του ροδίου από το 1992 έως το 2009 (δολάρια/ουγγιά)
-
Συγκριτικές τιμές ευγενών μετάλλων τον Ιανουάριο του 2010
Ούτε το επενδυτικό κοινό αλλά ούτε και η Wall Street ασχολούνται ιδιαίτερα με το ρόδιο και μόνο λίγοι επενδυτές και διεθνή ινστιτούτα επενδύουν σ' αυτό το εξαιρετικά σπάνιο μέταλλο. Κερδοσκοπικά παιχνίδια δε γίνονται με το ρόδιο και μάλιστα οι περισσότεροι επενδυτές δεν έχουν καν ακούσει γι' αυτό.
Ιδιότητες
Φυσικές
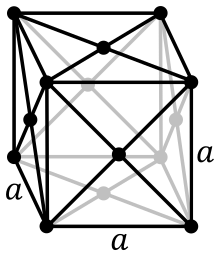
α = 380,4 pm
Το ρόδιο είναι σκληρό ασημί λευκό και ανθεκτικό μέταλλο που έχει υψηλό συντελεστή ανάκλασης. Έχει υψηλότερο σημείο τήξης (13ο κατά σειρά χημικό στοιχείο) και βρασμού (19ο κατά σειρά χημικό στοιχείο),[22] από το λευκόχρυσο, το σίδηρο και το νικέλιο σε όλες τις πιέσεις, μικρότερη πυκνότητα από την πλατίνα[23] και, μαζί με το Ir, την υψηλότερη ειδική θερμότητα, θερμική και ηλεκτρική αγωγιμότητα όλων των PGM.
Το ρόδιο κρυσταλλώνεται στο κυβικό σύστημα και γίνεται υπεραγώγιμο κάτω από 0,9 Κ.[13]
Είναι παραμαγνητικό μέταλλο διότι έχει μονήρη ηλεκτρόνια τα οποία συμπεριφέρονται ως στοιχειώδεις μαγνήτες και έλκονται από μαγνητικά πεδία.
Η τάση των ατμών του είναι αμελητέα και μετρήσιμη μόνο σε υψηλές θερμοκρασίες: στους 2015 °C είναι μόνο 10−5 Atm και φθάνει στη 1 Atm στους 3724 °C.
Μηχανικές ιδιότητες[Σημ. 3]
Το ρόδιο είναι σκληρότερο από το χρυσό ή την πλατίνα, αλλά μπορεί να κατεργαστεί με σφυρηλάτηση.[24] Η θερμοκρασία στην οποία μετατρέπεται από εύθρυπτο μέταλλο σε όλκιμο είναι -196 °C. Το μέτρο ελαστικότητάς του (Young) είναι σε όλες τις θερμοκρασίες μικρότερο του Ir αλλά μεγαλύτερο από του Pt και του Pd.
Θερμικές ιδιότητες
Η θερμική του αγωγιμότητα είναι πολύ υψηλή και παραμένει σχεδόν σταθερή μεταξύ 0 °C και 100 °C, περίπου 145 W/(m.K).[24] Είναι σχεδόν ίδια με αυτήν του ιριδίου και υψηλότερη από τις θερμικές αγωγιμότητες των άλλων PGM.
Οπτικές ιδιότητες
Ανακλά το ορατό φως από 76 % έως 82 %.[24] Είναι εξαιρετικά λαμπρό μέταλλο που έχει την ίδια λαμπρότητα με το χρυσό, μικρότερη από τον άργυρο και μεγαλύτερη από τα άλλα PGM.
Ηλεκτρικές ιδιότητες
Το ρόδιο είναι άριστος αγωγός του ηλεκτρικού ρεύματος. Έχει τη μεγαλύτερη αγωγιμότητα από όλα τα PGM σε όλες τις θερμοκρασίες εκτός από το Ir που έχει σχεδόν την ίδια αγωγιμότητα. Έχει τη 8η μεγαλύτερη ηλεκτρική αγωγιμότητα από όλα τα χημικά στοιχεία.
Χημικές
Το ρόδιο ανήκει στη β' σειρά των μεταβατικών μετάλλων ή στοιχείων μετάπτωσης. Στα μέταλλα μετάπτωσης ανήκουν τα χημικά στοιχεία που έχουν ασυμπλήρωτη την ομάδα των d ατομικών τροχιακών της προτελευταίας ηλεκτρονιακής στιβάδας.
Το φάσμα εκπομπής του Rh είναι περίπλοκο επειδή διαθέτει πολλά τροχιακά παραπλήσιας ενέργειας και τα ηλεκτρόνια έχουν πολλές επιλογές όταν μεταβαίνουν από το ένα τροχιακό στο άλλο. Οι μεταβάσεις αυτές προϋποθέτουν απορρόφηση ενέργειας και στη συνέχεια επανεκπομπή της. Έτσι παρουσιάζεται το διάχυτο φάσμα εκπομπής και γι' αυτό το ρόδιο ανήκει στο d-block (το d στα αγγλικά αντιπροσωπεύει τη λέξη diffuse που σημαίνει διάχυτος).[25]
Οι ενέργειες ιονισμού (σε KJ/mol) των σταδιακών μετατροπών του ροδίου σε ιόντα από Rh+ έως Rh9+ καθώς και τα δυναμικά ημιαντιδράσεων αναγωγής διαφόρων ενώσεων[13] και ιόντων του Rh, βρίσκονται στους πίνακες που ακολουθούν :
| Μετατροπή | Ενέργεια ιονισμού (KJ/mol) |
|---|---|
| Rh - Rh+ | 720 |
| Rh+ - Rh2+ | 1744 |
| Rh2+ - Rh3+ | 2997 |
| Rh3+ - Rh4+ | 4400 |
| Rh4+ - Rh5+ | 6500 |
| Rh5+ - Rh6+ | 8200 |
| Rh6+ - Rh7+ | 10100 |
| Rh7+ - Rh8+ | 12200 |
| Rh8+ - Rh9+ | 14200 |
| Rh8+ - Rh9+ | 22000 |
| Ημιαντίδραση | Δυναμικό Ε0 (V) |
|---|---|
| Rh3+ + 3e- ⇆ Rh | +0.8 |
| RhCl63- + 3e- ⇆ Rh + 6Cl- | +0.44 |
| RhCl62- + 4e- ⇆ Rh + 6Cl- | +0.835 |
| Rh2O3 + 6H+ + 6e- ⇆ 2Rh + 3H2Ο | +0.87 |
| RhO2 + 4H+ + 6Cl- + e- ⇆ RhCl63- + 2H2O | +1.4 |
| RhO2+ + 2H+ + e- ⇆ Rh3+ + H2Ο | +1.40 |
| RhO42- + 6H+ + 2e- ⇆ RhO2+ + 3H2Ο | +1.46 |
| Ατομικός αριθμός (Ζ) |
Χημικό στοιχείο | Ηλεκτρόνια ανά στιβάδα |
|---|---|---|
| 27 | Κοβάλτιο | 2, 8, 15, 2 |
| 45 | Ρόδιο | 2, 8, 18, 16, 1 |
| 77 | Ιρίδιο | 2, 8, 18, 32, 15, 2 |
| 109 | Μαϊτνέριο | 2, 8, 18, 32, 32, 15, 2 |

Όπως φαίνεται σ' αυτούς τους πίνακες, το κανονικό δυναμικό αναγωγής της αντίδρασης : Rh3+ + 3e- ⇆ Rh είναι θετικό (+ 0,8 V) πράγμα που σημαίνει ότι το μέταλλο βρίσκεται μετά το υδρογόνο στην ηλεκτροχημική σειρά των μετάλλων, δεν αντικαθιστά το Η στις ενώσεις του (π.χ οξέα) και χημικώς θεωρείται ευγενές μέταλλο.
Το ρόδιο δεν αντιδρά με το νερό σε φυσιολογικές συνθήκες, είναι απρόσβλητο από τα οξέα ακόμη και από τα πυκνά, ενώ δε διαλύεται ούτε στο βασιλικό νερό. Πλήρης διάλυση επιτυγχάνεται μόνο σε πυκνό θειικό οξύ και όταν το ρόδιο είναι σε μορφή σκόνης. Δεν προσβάλλεται από το οξυγόνο της ατμόσφαιρας παρόλο που το απορροφά στη θερμοκρασία τήξης του. Ο ποσοτικός προσδιορισμός του ροδίου σε ένα δείγμα μπορεί να γίνει[26] με υδρόθειο σε όξινο διάλυμα αλλά για το φασματοφωτομετρικό προσδιορισμό μπορεί να χρησιμοποιηθεί και η 2-μερκαπτο-βενζο-θιαζόλη.[27]
Επίδραση οξέων
Το ρόδιο δε διαβρώνεται από τα οξέα (οργανικά ή ανόργανα, αραιά ή πυκνά, ασθενή ή ισχυρά) ούτε από το βασιλικό νερό. Πολύ μικρή διάβρωση παρατηρείται μόνο στους 100 °C από την επίδραση HBr 60 % και H2SO4 96 %.[24]
Επίδραση βάσεων
Δε διαβρώνεται από το τις βάσεις. Σε πολύ δραστικές συνθήκες (1 ώρα, 410 °C, ξηρό περιβάλλον, ατμόσφαιρα με 20 % έως 100 % Ο2), από επιφάνεια 8 cm2 ροδίου χάνονται περίπου 20 – 30 mg υλικού όταν επιδράσει λιωμένο NaOH, ενώ όταν επιδράσει λιωμένο ΚΟΗ στις ίδιες συνθήκες, υπάρχει απώλεια μεγαλύτερη από 10 g.[24]
Επίδραση αλάτων
Πάρα πολύ μικρή διάβρωση παρατηρείται κατά την επίδραση διαλύματος υποχλωριώδους νατρίου (NaOCl). Από την επίδραση λιωμένου κυανιούχου καλίου (ΚCN) στο ρόδιο στους 700 °C παρατηρείται επιφανειακή απώλεια 11 mg Rh/cm2 την ημέρα, ενώ από την επίδραση λιωμένου ανθρακικού νατρίου (Na2CO3) στους 920 °C παρατηρείται αύξηση μάζας 0,48 mg/cm2 την ημέρα. Από την επίδραση λιωμένου όξινου θειικού καλίου (KHSO4) στους 440 °C παρατηρείται επιφανειακή απώλεια 11 mg Rh/cm2 την ημέρα.[24]
Αντιδράσεις του ροδίου με το Ο2
Με θέρμανση στους 300 - 1000 °C, το ρόδιο αντιδρά με το Ο2 δίνοντας σκούρο καφέ οξείδιο του ροδίου(ΙΙΙ), Rh2O3, το οποίο διασπάται στα στοιχεία του πάνω από 1000 °C:[28]
- 4Rh + 3O2 → 2Rh2O3
Υπάρχουν αναφορές της ύπαρξης του μαύρου οξειδίου του ροδίου(IV), RhO2 το οποίο σχηματίζεται σε θερμοκρασίες από 400 °C έως 900 °C και πίεση Ο2 πάνω από 3500 Atm:[28]
- Rh + O2 → RhO2
Το ασταθές RhO αποσυντίθεται πάνω από τους 1000 °C, ενώ το Rh2Ο αποσυντίθεται πάνω από τους 1100 °C.
Αντιδράσεις του ροδίου με τα αλογόνα[28]
Το Rh αντιδρά απευθείας με αέριο φθόριο στους 400 °C και σε πίεση 6 Atm :
- 2Rh + 5F2 → 2RhF5
Αλλα φθορίδια (RhF4, RhF6) σχηματίζονται έμμεσα.
Σε άνυδρες συνθήκες μπορούν να σχηματιστούν και τριαλογονίδια του ροδίου(ΙΙΙ) :
Στους 800 °C :
- 2Rh + 3Cl2 → 2RhCl3
Με θέρμανση με 45 % HBr/Br2 και μετά στους 400 °C με Br2 :
- 2Rh + 3Br2 → 2RhBr3 (κόκκινο)
Στους 400 °C :
- 2Rh + 3Ι2 → 2RhΙ3 (μαύρο)
Ισότοπα
Το ρόδιο βρίσκεται στη φύση με τη μορφή ενός μόνο ισοτόπου, του 103Rh. Τα σταθερότερα ραδιοϊσότοπα είναι το 101Rh, το 102Rh, το 102mRh και το 99Rh με ημιζωές από 3,3 χρόνια μέχρι 16,1 ημέρες. Έχουν ταυτοποιηθεί άλλα είκοσι ραδιοϊσότοπα. Τα περισσότερα από αυτά έχουν χρόνους ημιζωής μικρότερους από 1 ώρα.
Υπάρχουν ακόμη κάποια μετασταθή ισότοπα με σταθερότερο το 102mRh και το 101mRh.
Επειδή το 103Rh είναι σταθερό, δεν έχει προϊόντα αποσύνθεσης, έτσι σ' αυτό καταλήγει το ισότοπο του ρουθηνίου 103Ru με β--διάσπαση και το ισότοπο του παλλαδίου 103Pd με αρπαγή ηλεκτρονίου.
Περιβαλλοντικοί κίνδυνοι - Βιολογικός ρόλος - Προφυλάξεις
Το ρόδιο είναι αδρανές μέταλλο και αν χρησιμοποιηθεί στη στοιχειακή του μορφή, είναι ακίνδυνο. Δεν υπάρχουν ενδείξεις από πειραματικά δεδομένα ή βιομηχανική εμπειρία ότι οι διαλυτές ενώσεις του ροδίου έχουν τοξικές επιδράσεις στον άνθρωπο.[29] Αναφέρεται
[30] ότι όταν ποντίκια ήπιαν νερό που περιείχε 5 ppm ρόδιο, ανέπτυξαν λευχαιμία.
Ορισμένες χώρες από το 1993 έως και το 2008 έχουν θεσπίσει όρια έκθεσης των εργαζομένων στο ρόδιο.[31]
Σύμφωνα με την OSHA,[Σημ. 4] το ανώτατο επιτρεπόμενο όριο έκθεσης για τους ατμούς μεταλλικού ροδίου και τις αδιάλυτες ενώσεις του είναι 0,1 mg/m3[32] και για τις ευδιάλυτες ενώσεις του 0,001 mg/m3,[33] με βάση την εργάσιμη ημέρα των 8 ωρών, τις 40 ώρες εργασίας την εβδομάδα και σε όλους τους εργασιακούς χώρους.
Σύμφωνα με το NIOSH,[Σημ. 5] η μέγιστη συνιστώμενη τιμή τυχαίας έκθεσης σε ατμούς μεταλλικού ροδίου και σε αδιάλυτες ενώσεις του είναι τα 100 mg/m3,[34] ενώ για ευδιάλυτες ενώσεις του είναι 2 mg/m3.[35] Αυτές οι συγκεντρώσεις είναι οι μέγιστες και αν εκτεθεί κάποιος σε μικρότερες, θα μπορούσε να ξεφύγει μέσα σε 30 λεπτά χωρίς αμετάκλητες επιπτώσεις στην υγεία του.[32]
Η σκόνη ροδίου είναι εύφλεκτη εφόσον αναμιχθεί με τον αέρα και μπορεί να απορροφηθεί από τον οργανισμό του ανθρώπου με την εισπνοή αερολύματος παρόλο που έχει αμελητέα τάση ατμών στους 20 °C.
Οι ενώσεις του ροδίου συναντώνται σχετικά σπάνια από τους περισσότερους ανθρώπους και χρησιμοποιούνται μόνο στη χημική βιομηχανία. Όλες πρέπει να θεωρούνται ως ιδιαίτερα τοξικές και καρκινογόνες. Οι ενώσεις του ροδίου αφήνουν έντονα σημάδια στο ανθρώπινο δέρμα.
Το χλωριούχο ρόδιο(ΙΙΙ), RhCl3, διαπιστώθηκε ότι είναι μια ουσία χαμηλής τοξικότητας, όταν χορηγείται σε αρουραίους και κουνέλια. Η LD50[Σημ. 6] για το RhCl3 που χορηγείται με ένεση στον ενήλικο αρσενικό αρουραίο ράτσας Sprague-Dawley ήταν 198 mg/ kg και για το ενήλικο αρσενικό Νέας Ζηλανδίας ήταν 215 mg/kg. Ιστοπαθολογικές μελέτες που πραγματοποιήθηκαν στα σημαντικότερα όργανα των δύο αυτών ζώων, δεν έδειξαν παθολογικές αλλοιώσεις.[36]
Δοκιμή σε φυτά έχει δείξει ότι το ρόδιο είναι το λιγότερο τοξικό μέλος των μετάλλων της ομάδας του λευκόχρυσου.
Ενώσεις του ροδίου
| Ένωση | Χρώμα | Ένωση | Χρώμα |
|---|---|---|---|
RhCl3 |
RhBr3 |
||
RhI3 |
RhF3 |
||
RhF4 |
RhF6 |
Οι περισσότερες ενώσεις του ροδίου (αλλά και γενικά των στοιχείων μετάπτωσης) είναι έγχρωμες γιατί ο αριθμός των διαθέσιμων τροχιακών στα οποία μπορεί να μεταπηδήσει ένα ηλεκτρόνιο όταν διεγερθεί είναι μεγάλος, οπότε η ενέργεια που χρειάζεται για να αλλάξει τροχιακό είναι πολύ μικρή και η ενέργεια της ορατής περιοχής του φάσματος είναι επαρκής. Έτσι, απορροφούνται ορισμένα μήκη κύματος του ορατού φωτός και οι ενώσεις φαίνονται έγχρωμες.[25]
Οι γνωστότερες δυαδικές ενώσεις του Rh+3 και του Rh+4 με αμέταλλα στοιχεία καθώς και μοντέλα κρυσταλλικής δομής ορισμένων ενώσεων του ροδίου, βρίσκονται στους πίνακες που ακολουθούν:
| Όνομα ένωσης | Χημικός τύπος |
|---|---|
| Οξείδιο του ροδίου(ΙΙΙ) | Rh2O3 |
| Χλωριούχο ρόδιο(ΙΙΙ) | RhCl3 |
| Ιωδιούχο ρόδιο(ΙΙΙ) | RhI3 |
| Βρωμιούχο ρόδιο(ΙΙΙ) | RhBr3 |
| Φθοριούχο ρόδιο(ΙΙΙ) | RhF3 |
| Θειούχο ρόδιο(ΙΙΙ) | Rh2S3 |
| Όνομα ένωσης | Χημικός τύπος |
|---|---|
| Οξείδιο του ροδίου(IV) | RhO2 |
| Φθοριούχο ρόδιο(ΙV) | RhF4 |
| Θειούχο ρόδιο(IV) | RhS2 |
| Σεληνιούχο ρόδιο(IV) | RhSe2 |
| Τελλουριούχο ρόδιο(IV) | RhTe2 |
- Στερεοχημικά μοντέλα κρυστάλλων ορισμένων ενώσεων του ροδίου
-
RhCl3
-
Rh2O3
-
RhO2
-
Rh4(CO)12
| Αριθμός οξείδωσης |
Ένωση |
|---|---|
| >0 | Rh4(CO)12, Rh2(CO)8, Rh8(CO)16 |
| +1 | RhCl(PH3)2 |
| +2 | Rh2(O2CCH3)4 |
| +3 | RhCl3, Rh2O3 |
| +4 | RhF4, RhO2 |
| +5 | RhF5, Sr3LiRhO6 |
| +6 | RhF6 |
Ο συνηθέστερος αριθμός οξείδωσης του ροδίου είναι +3 αλλά έχουν μελετηθεί και ενώσεις με αριθμούς οξείδωσης 0 (η καλύτερα μελετημένη ένωση στην οποία το ρόδιο έχει α.ο. 0 είναι η Rh2(PF3)8) έως +6. Σε αντίθεση με το ρουθήνιο και το όσμιο, το ρόδιο δε σχηματίζει πτητικές ενώσεις με το οξυγόνο. Τα πλέον σταθερά οξείδια είναι το οξείδιο του ροδίου(ΙΙΙ), Rh2O3 και το οξείδιο του ροδίου(IV) τόσο το άνυδρο (RhO2) όσο και το ένυδρο (RhO2·xH2O). Επίσης είναι γνωστά μικτά άλατα ροδίου(V) με στρόντιο -λίθιο, Sr3LiRhO6 και στρόντιο-νάτριο, Sr3NaRhO6 καθώς και ενώσεις του ροδίου με τα αλογόνα σχεδόν σε όλες τις οξειδωτικές καταστάσεις όπως π.χ. χλωριούχο ρόδιο(ΙΙΙ) άνυδρο, RhCl3, ή και ένυδρο, RhCl3.3Η2Ο,[Σημ. 7] φθοριούχο ρόδιο(IV), RhF4, φθοριούχο ρόδιο(V), RhF5 και φθοριούχο ρόδιο(VI), RhF6. Πρόσφατα έχουν μελετηθεί και ελαφρώς όξινα εφυδατωμένα ιόντα της μορφής Rh(H2O)63+, στα οποία τα μόρια του νερού μπορούν αν αντικατασταθούν από άτομα χλωρίου (π.χ. RhCl(H2O)52+). Το ένυδρο υδροξείδιο Rh(OH)3.3H2Ο μπορεί να παραχθεί ως κίτρινο ίζημα με προσεκτική προσθήκη βάσης στο άλας Na3RhCl6.
Σύμπλοκα του ροδίου
Οι πιο ενδιαφέρουσες και χρήσιμες στην επιστήμη και στην τεχνολογία ενώσεις του ροδίου (και γενικότερα των στοιχείων μετάπτωσης) είναι οι ενώσεις συναρμογής του. Αυτά τα σύμπλοκα παρουσιάζουν αυξανόμενη συνεχώς σημασία για την Οργανική Χημεία ως καταλύτες εξαιρετικής ισχύος και εκλεκτικότητας.
Το ρόδιο σχηματίζει σύμπλοκα με βαθμίδες οξείδωσης κυρίως +1, +2, +3 και +4 με αντίστοιχες ηλεκτρονικές διαμορφώσεις στα d τροχιακά : d8, d7, d6 και d5.

Τα σύμπλοκα του ροδίου(Ι) είναι τετραγωνικά και χρησιμοποιούνται σαν δραστικότατοι καταλύτες σε αντιδράσεις οξειδωτικής προσθήκης όπως για παράδειγμα το trans-καρβονυλο-χλωρο-δισ(τριφαινυλοφωσφινο) ρόδιο(Ι), trans-RhCl(CO)((PPh3)2 αλλά και το καρβονυλο-υδριδο-τρισ(τριφαινυλοφωσφινο) ρόδιο (Ι), RhH(CO)(PPh3)3. Γενικά όσο πιο πολλά μόρια τριφαινυλοφωσφίνης, (C6H5)3P ή PPh3), έχει το σύμπλοκο, τόσο δραστικότερος καταλύτης είναι.[37]
Υπάρχουν λίγα γνωστά σύμπλοκα του ροδίου(ΙΙ).[19]
Τα σύμπλοκα του ροδίου(ΙΙΙ) είναι συνήθως οκταεδρικά με αριθμό συναρμογής 6[19][Σημ. 9] π.χ. το ιόν εξαφθοριούχο ρόδιο [RhF6]3-.
Στα μεταλλοκαρβονύλιά του το ρόδιο έχει αριθμό οξείδωσης 0. Έχουν μελετηθεί τα[38] : οκτακαρβονυλο-ρόδιο, Rh2(CO)8, δεκαεξικαρβονυλο-ρόδιο Rh6(CO)16 και το Rh4(CO)12 και το δωδεκακαρβονυλο-ρόδιο το οποίο είναι ιδιαίτερα δραστικό αλλά έχει φτωχή εκλεκτικότητα.[37]
Από τα σύμπλοκα με υδρογονάνθρακες, αναφέρεται το κοκκινο-πορτοκαλί σύμπλοκο με χλώριο και αιθένιο, Rh2Cl2(C2H4)4, που παράγεται εύκολα από αιθένιο και RhCl3.3H2O.[28] Το πιο σημαντικό εναμμώνιο σύμπλοκο του Rh+3 είναι το [Rh(NH3)5Cl]Cl2 που αποτελεί πρόδρομη ένωση για δεκάδες άλλα σύμπλοκα.[28]
Ο καταλύτης Wilkinson

Ο καταλύτης Wilkinson είναι σύμπλοκο του ροδίου που ονομάζεται χλωροτρισ(τριφαινυλοφωσφινο)ρόδιο(Ι) και έχει το χημικό τύπο RhCl(PPh3)3 όπου το Ph συμβολίζει την ομάδα φαινύλιο, C6H5-. Ο υποκατάστατης Ph3P είναι η τριφαινυλοφωσφίνη.[39]
Έχει διαπιστωθεί ότι το σύμπλοκο Wilkinson σε βενζολικό ή μικτό βενζολικό-αιθανολικό διάλυμα αποτελεί άριστο καταλύτη και χρησιμοποιείται ευρύτατα στην ομογενή υδρογόνωση ακόρεστων ενώσεων, όπως είναι π.χ. η υδρογόνωση αλκενίων. Επίσης καταλύει την αποκαρβονυλίωση καρβονυλικών ενώσεων.[19]
Η μέθοδος Monsanto
Μεγάλο βιομηχανικό ενδιαφέρον παρουσιάζει το σύμπλοκο ανιόν cis-δικαρβονυλο-ρόδιο-διιώδιο, cis-[Rh(CO)2I2]-, το οποίο καταλύει την καρβονυλίωση της μεθανόλης, CH3OH, στην παραγωγή οξικού οξέος, CH3COOH. με τη μέθοδο Monsanto.[40] Η μέθοδος αυτή έχει εκλεκτικότητα μεγαλύτερη από 99% και πραγματοποιείται σε πίεσεις 30–60 Atm και θερμοκρασίες 150–200 °C. Η διαδικασία της Monsanto έχει σήμερα αντικατασταθεί σε μεγάλο βαθμό από τη διαδικασία Cativa,[41] όπου χρησιμοποιείται σύμπλοκο του ιριδίου και είναι πιο οικονομική και περισσότερο φιλική προς το περιβάλλον. Πάντως, και οι δύο μέθοδοι επιλέχθηκαν επειδή ελαχιστοποιείται η παραγωγή υποπροϊόντων ενώ ταυτόχρονα δεν περισσεύουν αντιδρώντα υλικά.[37]
Εφαρμογές
| Εφαρμογές | 2006 | 2007 |
|---|---|---|
| Καταλύτες αυτοκινήτων[Σημ. 10] |
692 (83%) | 696 (81%) |
| Γυαλί | 65 (8%) | 64 (7%) |
| Χημικές | 49 (6%) | 64 (7%) |
| Ηλεκτρικές | 9 (1%) | 9 (1%) |
| Άλλες | 23 (2%) | 23 (3%) |
| Συνολική ζήτηση | 838 |
856
|
Καταλύτες

Το 2006 και το 2007, πάνω από το 80 %[42] της παγκόσμιας παραγωγής ροδίου χρησιμοποιήθηκε στην κατασκευή τριοδικών καταλυτών. Το Rh φαίνεται να παρουσιάζει ορισμένα πλεονεκτήματα έναντι των άλλων μετάλλων της ομάδας του λευκόχρυσου στην αναγωγή των οξειδίων του αζώτου (ΝΟx) προς άζωτο και οξυγόνο : 2NOx → xO2 + N2.
Η ανακύκλωση των καταλυτών είναι επίσης μια πολύτιμη πηγή ροδίου. Το 2007, προήλθαν από αυτή την πηγή περίπου 5,7 τόννοι. Σε σύγκριση με τους 22 τόννους που είχαν εξορυχθεί εκείνη τη χρονιά, είναι σχεδόν το 1/4.[42]
Οι καταλύτες που βασίζονται στο Rh χρησιμοποιούνται σε πολλές βιομηχανικές διαδικασίες όπως π.χ. στην καταλυτική καρβονυλίωση της μεθανόλης για τη σύνθεση οξικού οξέος (μέθοδος Monsanto), στην κατάλυση της προσθήκης υδρογονοπυριτικών ενώσεων[Σημ. 11] σε διπλούς δεσμούς με αποτέλεσμα την παραγωγή ορισμένου τύπου λάστιχων σιλικόνης,[43] στην αναγωγή του βενζολίου προς κυκλοεξάνιο[44] κ.ά.
Διακοσμητικές χρήσεις

Το ρόδιο χρησιμοποιείται στα κοσμήματα και σε διακοσμητικά αντικείμενα όπως βέρες, μπρελόκ κ.ά. Επικαλύπτει ηλεκτρολυτικά το «λευκό χρυσό» και την πλατίνα προσδίδοντας έτσι λάμψη επειδή είναι μέταλλο υψηλής ανακλαστικότητας. Αυτό στην κατασκευή κοσμημάτων είναι γνωστό ως «λάμψη ροδίου». Χρησιμοποιείται επίσης στην επικάλυψη «ασημένιων»[Σημ. 12] αντικειμένων για την προστασία τους από το μαύρισμα και το θάμπωμα που οφείλεται στη δημιουργία θειούχου αργύρου, Ag2S εξαιτίας του υδρόθειου, H2S της ατμόσφαιρας.
Κοσμήματα από καθαρό ρόδιο είναι πολύ σπάνια, όχι τόσο λόγω της υψηλής τιμής του αλλά διότι το μέταλλο έχει πολύ υψηλό σημείο τήξης, μικρή πλαστικότητα και μεγάλη δυσκολία στην κατεργασία του.[45]
Σχετικά πρόσφατα, το ρόδιο άρχισε να χρησιμοποιείται και σε συλλεκτικά αντικείμενα, νομίσματα, μετάλλια κ.ά. ή για να συμβολίσει υγεία και ευεξία, όταν τα άλλα πολύτιμα μέταλλα (χρυσός, άργυρος, πλατίνα) κρίνονται ανεπαρκή. Είναι ενδιαφέρον το γεγονός ότι το Βιβλίο Ρεκόρ Γκίνες (Guinness Book of World Records), έδωσε το 1979 στον Πωλ ΜακKάρτνϋ (Paul McCartney)[Σημ. 13] ένα δίσκο με επίστρωση ροδίου ως βραβείο για τις περισσότερες πωλήσεις δίσκων ποπ μουσικής όλων των εποχών που έκανε ως τραγουδιστής και συνθέτης.[46] Το ίδιο Βιβλίο έχει σημειώσει, επίσης, ως την «ακριβότερη πένα του κόσμου» ή «το πιο ακριβό επιτραπέζιο παιχνίδι» για κάποια αντικείμενα που περιέχουν ρόδιο.
Άλλες εφαρμογές
Το ρόδιο χρησιμοποιείται ως παράγοντας σκλήρυνσης κραμάτων λευκόχρυσου και παλλαδίου και βελτίωσης της αντοχής τους στη διάβρωση. Αυτά τα κράματα χρησιμοποιούνται σε περιελίξεις υψικαμίνων, ως λιπαντικά στην παραγωγή υαλοβάμβακα, ως θερμοστοιχεία, ως ηλεκτρόδια στα μπουζί των αεροσκαφών και ως χωνευτήρια σε χημικά εργαστήρια.[47]
Το ρόδιο χρησιμοποιείται ακόμη:
- Ως υλικό σε ηλεκτρικές επαφές[48] λόγω της μεγάλης του αγωγιμότητας, της αντοχής του στη διάβρωση και στις υψηλές θερμοκρασίες. Κράμα που περιέχει 87 % λευκόχρυσο και 13 % ρόδιο όταν συνδυάζεται με καθαρή πλατίνα, χρησιμοποιείται ως θερμοζεύγος σε περιοχή θερμοκρασιών 1000 °C - 1650 °C.[49]
- Λόγω της εξαιρετικής του σκληρότητας, σε ευαίσθητα εξαρτήματα οπτικών οργάνων[50] που δεν πρέπει να παραμορφώνονται από εξωτερικούς παράγοντες.
- Ως φίλτρο σε συστήματα μαστογραφίας,[51] λόγω των χαρακτηριστικών ακτίνων-Χ που παράγει.
- Σε υψηλής ποιότητας πένες των εταιρειών Graf von Faber-Castell[52] και Caran d’Ache,[53] λόγω της μεγάλης χημικής και μηχανικής του αντοχής.
- Σε ανιχνευτές βραδέων νετρονίων των πυρηνικών αντιδραστήρων εσωτερικής ανάφλεξης για τη μέτρηση της ροής νετρονίων. Η μέθοδος πρωτοαναπτύχθηκε το 1936 από τους Amaldi και Fermi οι οποίοι χρησιμοποίησαν ανιχνευτές με ρόδιο και άργυρο[54] οι οποίοι αποδείχθηκαν αποτελεσματικότεροι από τους ανιχνευτές που χρησιμοποιούσαν μόνο άργυρο.
Σημειώσεις
- ↑ Το Becquerel (Bq) είναι μονάδα ραδιενέργειας στο SI. 1 Bq = 1 μεταστοιχείωση/s. 1 MBq = 106 Bq
- ↑ Το 1 κιουρί (Ci) είναι παλιότερη και μεγαλύτερη από το 1 Bq μονάδα ραδιενέργειας. 1 Ci = 3,7×1010 Bq δηλ. 3,7×1010 μεταστοιχειώσεις/δευτερόλεπτο
- ↑ Στις μηχανικές ιδιότητες ανήκει και η ελατότητα (malleability) και η ολκιμότητα (ductility). Ελατότητα μετάλλου ή μεταλλικού κράματος είναι η φυσική ιδιότητα με βάση την οποία τα υλικά μετατρέπονται στην επιθυμητή μορφή με σφυρηλάτηση. Ολκιμότητα είναι η φυσική ιδιότητα που έχουν πολλά μέταλλα και η οποία τα επιτρέπει να μετατρέπονται σε νήματα ή σύρματα.
- ↑ "Occupational Safety and Health Administration". Ομοσπονδιακή υπηρεσία των Η.Π.Α. που ανήκει στο Υπουργείο Εργασίας και είναι υπεύθυνη για τη σύνταξη και την εφαρμογή ομοσπονδιακών κανονισμών που σχετίζονται με την ασφάλεια στο χώρο εργασίας.
- ↑ "National Institute for Occupational Safety and Health". Είναι το "Εθνικό Ινστιτούτο Επαγγελματικής Ασφάλειας και Υγείας" των Η.Π.Α. και είναι υπεύθυνο, για την έρευνα και την ανάπτυξη ενώ συστήνει, χωρίς να νομοθετεί, πρότυπα υγείας και ασφάλειας.
- ↑ Στην τοξικολογία,η μέση τιμή θανατηφόρας δόσης, LD50, μιας τοξικής ουσίας ή ακτινοβολίας είναι η δόση που απαιτείται για να σκοτώσει τα μισά από τα πειραματόζωα ενός πληθυσμού όταν δοκιμάζεται για ορισμένο χρονικό διάστημα. Η LD50 χρησιμοποιείται συχνά ως γενικός δείκτης της οξείας τοξικότητας μιας ουσίας και παρόλο που καταργείται σταδιακά, χρησιμοποιείται ακόμη ευρέως για λόγους σύγκρισης.
- ↑ Από το ένυδρο χλωριούχο ρόδιο (ΙΙΙ) παρασκευάζεται μεγάλος αριθμός συμπλόκων ενώσεων του ροδίου με χλώριο
- ↑ Το όνομα του συμπλόκου είναι : Το μετά νατρίου σουλφουνομένο άλας του καρβονυλο-υδριδο-τρισ(τριφαινυλοφωσφινο) ροδίου(Ι). Η ομάδα Tppts είναι η PPh3SO3-Na+
- ↑ Είναι το πλήθος των ligands ή περιφερειακών υποκαταστατών δηλ. των άλλων ατόμων, ιόντων, ουδέτερων μορίων που ενώνονται (συναρμόζονται) με το κεντρικό μέταλλο, εδώ το ρόδιο.
- ↑ Συμπεριλαμβάνεται η ανάκτηση Rh από τους καταλύτες
- ↑ Είναι οργανικές ενώσεις που προκύπτουν από τα σιλάνια όταν ένα ή περισσότερα άτομα Η αντικατασταθούν από αλκυλομάδες
- ↑ Όχι από ατόφιο ασήμι αλλά από κράμα με 92.5% w/w άργυρο και 7.5% w/w άλλο μέταλλο συνήθως χαλκό. Είναι τα αντικείμενα 925 βαθμών.
- ↑ Ο Sir James Paul McCartney (1942-) είναι Άγγλος τραγουδιστής και συνθέτης, πρώην μέλος του συγκροτήματος των Μπιτλς
Παραπομπές
- ↑ WolframAlpha : Rhodium
- ↑ Ron Miller (2006). The elements: what you really want to know. Lerner Publishing Group. σελ. 91.
- ↑ William Hyde Wollaston (January 1, 1804). «On a New Metal, Found in Crude Platina». Phil. Trans. R. Soc. Lond 94: 419-430. http://upload.wikimedia.org/wikipedia/commons/f/fc/Wollaston-On_a_New_Metal,_Found_in_Crude_Platina.pdf.
- ↑ 4,0 4,1 4,2 4,3 W. P. Griffith (2003). «Rhodium and Palladium – Events Surrounding Its Discovery». Platinum Metals Review 47 (4): 175–183. Αρχειοθετήθηκε από το πρωτότυπο στις 2013-07-04. https://www.webcitation.org/6HrP6vKEt?url=http://www.platinummetalsreview.com/article/47/4/175-183/. Ανακτήθηκε στις 2010-04-11.
- ↑ Lide, David R (2004). CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. Boca Raton: CRC Press. σελίδες 4–26. ISBN 0-8493-0485-7.
- ↑ Robert E. Krebs (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Press. σελ. 137.
- ↑ W. P. Griffith (2004). «Osmium and Iridium – Events Surrounding Its Discovery». Platinum Metals Review 48 (4): 182-189. Αρχειοθετήθηκε από το πρωτότυπο στις 2013-07-04. https://www.webcitation.org/6HrP8Kp9T?url=http://www.platinummetalsreview.com/article/48/4/182-189/. Ανακτήθηκε στις 2010-05-08.
- ↑ Platinum 2009 Interim Review, 17th November 2009
- ↑ O'Connell, Rhona (13 Apr 2007). «Gold mine production costs up by 17% in 2006 while output fell». Αρχειοθετήθηκε από το πρωτότυπο στις 2014-10-06. https://web.archive.org/web/20141006084904/http://www.mineweb.net/mineweb/view/mineweb/en/page33?oid=19485&sn=Detail. Ανακτήθηκε στις 2010-05-07.
- ↑ 10,0 10,1 Bushveld Complex and Great Dyke location map[νεκρός σύνδεσμος]
- ↑ 11,0 11,1 Hartman, H. L.· Britton, S. G., επιμ. (1992). SME mining engineering handbook. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. σελ. 69. ISBN 9780873351003.
- ↑ 12,0 12,1 Johnson Matthey PLATINUM Today
- ↑ 13,0 13,1 13,2 13,3 webelements : Rhodium
- ↑ Καζάκης Ν., Βαβελίδης Μ. (2006). P.G.M Μέταλλα της ομάδας του Λευκόχρυσου (PDF). Πανεπιστήμιο Θεσσαλονίκης Τμήμα Γεωλογίας. σελίδες 1–23.
- ↑ C. R. Hammond (2000). The elements (PDF). CRC press. σελίδες 4–24.
- ↑ Σημειώσεις Κοιτασματολογίας (PDF). Πανεπιστήμιο Πατρών Τμήμα Γεωλογίας. σελίδες 110–136. Αρχειοθετήθηκε από το πρωτότυπο (PDF) στις 24 Μαΐου 2013. Ανακτήθηκε στις 8 Μαΐου 2010.
- ↑ 17,0 17,1 «United Nations Conference on Trade and Development (UNCTAD)». Αρχειοθετήθηκε από το πρωτότυπο στις 11 Μαΐου 2010. Ανακτήθηκε στις 15 Μαΐου 2010.
- ↑ SAVE Tangle Lakes[νεκρός σύνδεσμος]
- ↑ 19,0 19,1 19,2 19,3 Μανουσάκης Γ.Ε. (1983). Γενική και Ανόργανη Χημεία. τόμος 2. Εκδοτικός Οίκος Αφων Κυριακίδη, Θεσσαλονίκη. σελίδες 471–487.
- ↑ Bush, R. P. (1991). «Recovery of Platinum Group Metals from High Level Radioactive Waste». Platinum Metals Review 35 (4): 202–208.
- ↑ 21,0 21,1 21,2 PLATINUM Today Price Charts
- ↑ WolframAlpha : Rh, Pd, Fe, Ni melting points
- ↑ WolframAlpha : Rh, Pd densities
- ↑ 24,0 24,1 24,2 24,3 24,4 24,5 «The PGM Database». Αρχειοθετήθηκε από το πρωτότυπο στις 10 Μαρτίου 2010. Ανακτήθηκε στις 11 Απριλίου 2010.
- ↑ 25,0 25,1 Μπαζάκης Ι.Α. Γενική Χημεία. Αθήνα.
- ↑ Robert R. Brooks (6 Απριλίου 1992). Noble Metals and Biological Systems: Their Role in Medicine, Mineral Exploration, and the Environment. CRC Press. σελ. 25.
- ↑ G. G. Tertipis, F. E. Beamish (May 1962). «Solvent Extraction Separation and Spectrophotometric Determination of Rhodium and Iridium.». Anal. Chem. 34 (6): 623-625. http://pubs.acs.org/doi/abs/10.1021/ac60186a011.
- ↑ 28,0 28,1 28,2 28,3 28,4 28,5 S.A. Cotton (1997). Chemistry of precious metals. Blackie Academic & Professional. σελίδες 78–87.
- ↑ The National Institute for Occupational Safety and Health (NIOSH) : Basis for original (SCP) IDLH
- ↑ John Emsley (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. σελ. 361.
- ↑ Rhodium Registry of Toxic Effects of Chemical Substances (RTECS)
- ↑ 32,0 32,1 Environmental Chemistry
- ↑ UNITED STATES DEPARTMENT OF LABOR, Occupational Safety & Health Administration
- ↑ NIOSH Pocket Guide to Chemical Hazards : Rhodium (metal fume and insoluble compounds, as Rh)
- ↑ NIOSH Pocket Guide to Chemical Hazards : Rhodium (soluble compounds, as Rh)
- ↑ Robert R. Landolt, Harold W. Berk and Henry T. Russell (April 1972). «Studies on the toxicity of rhodium trichloride in rats and rabbits». Toxicology and Applied Pharmacology 21 (4): 589-590. http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6WXH-4DDNKK0-3P&_user=10&_coverDate=04%2F30%2F1972&_rdoc=1&_fmt=high&_orig=search&_sort=d&_docanchor=&view=c&_searchStrId=1295030321&_rerunOrigin=google&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=5d25823d9d7454c1e9abb1f84e8311bf.[νεκρός σύνδεσμος]
- ↑ 37,0 37,1 37,2 Robert H. Crabtree (2005). The organometallic chemistry of the transition metals. John Wiley & Sons.
- ↑ Ιωάννης Α. Τοσσίδης (1986). Χημεία ενώσεων συναρμογής. Υπηρεσία Δημοσιευμάτων Α.Π.Θ. σελ. 62.
- ↑ John R. Sowa, Jr. (2005). Catalysis of Organic Reactions. CRC Press. σελίδες 59–62.
- ↑ Catherine E. Housecroft, A. G. Sharpe (2005). Inorganic Chemistry. Pearson Education Limited. σελίδες 793–795.
- ↑ Luis A. Oro,Carmen Claver (2009). Iridium Complexes in Organic Synthesis. WILEY-VCH. σελίδες 204–206. Αρχειοθετήθηκε από το πρωτότυπο στις 20 Σεπτεμβρίου 2011. Ανακτήθηκε στις 9 Μαΐου 2010.
- ↑ 42,0 42,1 George, Micheal W. «Commodity Report: Platinum-Group Metals» (PDF). United States Geological Survey USGS. Ανακτήθηκε στις 16 Σεπτεμβρίου 2008.
- ↑ Heidingsfeldova, M. and Capka, M. (2003). «Rhodium complexes as catalysts for hydrosilylation crosslinking of silicone rubber». Journal of Applied Polymer Science 30: 1837. doi:.
- ↑ Halligudi, S. B. et al. (1992). «Hydrogenation of benzene to cyclohexane catalyzed by rhodium(I) complex supported on montmorillonite clay». Reaction Kinetics and Catalysis Letters 48: 547. doi:. https://archive.org/details/sim_reaction-kinetics-and-catalysis-letters_1992-12_48_2/page/547.
- ↑ Fischer, Torkel; Fregert, S; Gruvberger, B; Rystedt, I (1984). «Contact sensitivity to nickel in white gold». Contact Dermatitis 10 (1): 23–24. doi:. PMID 6705515.
- ↑ Rayner W. Hesse, Jr. (2007). Jewelrymaking through history: an encyclopedia. Greenwood Publishing Group. σελ. 164.
- ↑ Lide, David R (2004). CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. Boca Raton: CRC Press. σελίδες 4–26. ISBN 0-8493-0485-7.
- ↑ Weisberg, Alfred M. (1999). «Rhodium plating». Metal Finishing 97 (1): 296–299. doi:.
- ↑ Mel M. Schwartz (2002). Encyclopedia of materials, parts, and finishes. CRC Press. σελ. 26.
- ↑ Smith, Warren J. (2007). «Reflectors». Modern optical engineering: the design of optical systems. McGraw-Hill. σελίδες 247–248. ISBN 9780071476874.
- ↑ McDonagh, C P et al. (1984). «Optimum x-ray spectra for mammography: choice of K-edge filters for tungsten anode tubes». Phys. Med. Biol. 29: 249. doi:.
- ↑ «Guilloche luxury pen range by Graf von Faber-Castell». Αρχειοθετήθηκε από το πρωτότυπο στις 1 Φεβρουαρίου 2010. Ανακτήθηκε στις 17 Απριλίου 2010.
- ↑ «Caran D'Ache Ecridor Type 55 Rhodium Fountain Pen». Αρχειοθετήθηκε από το πρωτότυπο στις 15 Ιουλίου 2011. Ανακτήθηκε στις 17 Απριλίου 2010.
- ↑ David Allan Bradley (1995). Power Electronics. University of Abertay Dundee (2η έκδοση). Scotland: CRC Press. σελίδες 201–202.
Επιλεγμένη βιβλιογραφία
- Brooks, Robert R. (1992). Noble Metals and Biological Systems: Their Role in Medicine, Mineral Exploration, and the Environment (1η έκδοση). CRC Press. ISBN 0-8493-6164-8.
- Cotton, Simon A. (1997). Chemistry of Precious Metals. New York: Springer. ISBN 978-0-7514-0413-5.
- Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (4η έκδοση). Yale University, New Haven, Connecticut: Wiley-Interscience. ISBN 0-4716-6256-9.
- Ebbing, Darrell D.· Gammon, Steven D. (2008). General Chemistry (9η έκδοση). Cengage Learning. ISBN 0-618-85748-6.
- Emsley, J. (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0-198-50340-7.
- Greenwood, Norman Neill· Earnshaw, Alan (1997). Chemistry of the Elements (2η έκδοση). Oxford: Butterworth–Heinemann. ISBN 0-7506-3365-4.
- Hartman, Howard L. (1992). SME Mining engineering handbook, Τόμος 1. Society for Mining, Metallurgy, and Exploration. ISBN 978-0-8733-5100-3.
- Hesse Jr., Rayner W. (2007). Jewelrymaking through History: An Encyclopedia (Handicrafts through World History). Greenwood Press. ISBN 978-0-31333-507-5.
- Housecroft, Catherine E.· Sharpe, Alan G. (2005). Inorganic chemistry. Pearson Education Limited. ISBN 978-0-1317-5553-6.
- Kotz, John C.· Treichel, Paul M.· Weaver, Gabriela C. (2005). Chemistry and chemical reactivity (6η έκδοση). Thomson Brooks/Cole. ISBN 0-534-99766-X.
- Krebs, R. E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Press. ISBN 978-0-4708-6403-6.
- Lide, David R. (2004). CRC Handbook of Chemistry and Physics: A ready-reference book of chemical and physical data (85η έκδοση). Boca Raton: CRC Press. ISBN 0-84930-485-7.
- Mackay, Ken M.· Mackay, Rosemary Ann· Henderson, W. (2002). Introduction to modern inorganic chemistry (6η έκδοση). CRC Press. ISBN 978-0-7487-6420-4. Ανακτήθηκε στις 28 Ιανουαρίου 2014.
- Miller, Ron (2004). The elements: What you Really want to know. Lerner Publishing Group. ISBN 0-7613-2794-0.
- Morrison, Robert Thornton· Boyd, Robert Neilson (1988). Οργανική Χημεία (3 Τόμοι) (4η έκδοση). Πανεπιστήμιο Ιωαννίνων. ISBN 0-1364-3669-2. Ανακτήθηκε στις 28 Ιανουαρίου 2014.[νεκρός σύνδεσμος] (μετάφραση: Σακαρέλλος, Κωνσταντίνος; Πηλίδης, Γεώργιος Α.; Γεροθανάσης, Ιωάννης Π.; κ.ά.).
- Μανουσάκης, Γεώργιος Ε. (1994). Γενική και Ανόργανη Χημεία. Θεσσαλονίκη: Αφοί Κυριακίδη. ISBN 960-343-272-5.
- Μπαζάκης, Ιωάννης Α. Γενική Χημεία. Αθήνα.
- Pauling, Linus (1988). General Chemistry (3η έκδοση). Dover Publications. ISBN 978-04866-5622-9.
- Schwartz, Mel (2002). Encyclopedia and Handbook of Materials, Parts and Finishes (2η έκδοση). CRC Press. ISBN 978-15667-6661-6.
- Smith, Warren J. (2007). Modern Optical Engineering: the design of optical systems (4η έκδοση). McGraw-Hill Professional. ISBN 978-007-147-687-4.
- Sowa Jr., John R. (2005). Catalysis of Organic Reactions (Chemical Industries) (1η έκδοση). CRC Press. ISBN 0-8247-2729-0.
- Τοσσίδης, Ιωάννης Α. (2001). Χημεία Ενώσεων Συναρμογής. Θεσσαλονίκη: Εκδόσεις Ζήτη. ISBN 978-96043-1754-7.
Δείτε επίσης
Εξωτερικοί σύνδεσμοι
- Theodore Gray : Elements Display
- Pictures of Rhodium, its minerals and applications
- Mineral Species containing Rhodium (Rh )
- The Periodic Table of Videos : Rhodium
- KITCO Rhodium Prices Charts
- Library of Inorganic Structures : Rh
| Περιοδικός πίνακας | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
|