2-χλωροβουτάνιο
| 2-χλωροβουτάνιο | |||
|---|---|---|---|
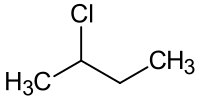
| |||
| Γενικά | |||
| Όνομα IUPAC | 2-χλωροβουτάνιο | ||
| Άλλες ονομασίες | 2-Βουτυλοχλωρίδιο Δευτεροταγές βουτυλοχλωρίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H9Cl | ||
| Μοριακή μάζα | 92,57 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2CHClCH3 | ||
| Συντομογραφίες | sBuCl | ||
| Αριθμός CAS | 78-86-4 22157-31-9 (R) 22156-91-8 (S) | ||
| SMILES | CCC(Cl)C | ||
| Δομή | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 3 1-χλωροβουτάνιο μεθυλο-1-χλωροπροπάνιο μεθυλο-2-χλωροπροπάνιο | ||
| Οπτικά ισομερή | 2 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -140 °C | ||
| Σημείο βρασμού | 70 °C | ||
| Πυκνότητα | 873 kg/m3 | ||
| Εμφάνιση | Υγρό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||

| |||
| Φράσεις κινδύνου | R11 | ||
| Φράσεις ασφαλείας | S7/9, S16, S29 | ||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
To 2-χλωροβουτάνιο ή 2-βουτυλοχλωρίδιο ή δευτεροταγές βουτυλοχλωρίδιο, σε δύο (2) οπτικά ισομερή[1], είναι ένα υγρό (στις συνηθισμένες συνθήκες, T = 25 °C, P = 1 atm) . Με βάση το χημικό τύπο του, C4H9Cl, έχει τα ακόλουθα τρία (3) ισομερές θέσης:
Ονοματολογία
Η ονομασία «χλωροβουτάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «βουτ-» δηλώνει την παρουσία τεσσάρων (4) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες που έχουν χαρακτηριστικές καταλήξεις. Το αρχικό πρόθεμα «χλωρο-» δηλώνει την παρουσία ενός (1) ατόμου χλωρίου ανά μόριο της ένωσης. Τέλος, ο αρχικός αριθμός θέσης «2-», δηλώνει τον αριθμό θέσης του ατόμου του άνθρακα με το οποίο ενώνεται το άτομο του χλωρίου, για να διαχωριστεί η ένωση από την ισομερή της 1-χλωροβουτάνιο.
Μοριακή δομή
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| C-Cl | σ | 2sp3-3sp3 | 176 pm | 9% C+ Cl- |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| H | +0,03 | |||
| C#1 | +0,06 | |||
| C#3 | -0,06 | |||
| C#1,#4 | -0,09 | |||
| Cl | -0,09 | |||
Παραγωγή
Με φωτοχημική χλωρίωση
Με φωτοχημική χλωρίωση βουτανίου παράγεται μίγμα 1-φθοροβουτανίου και 2-χλωροβουτανίου[3]:
- Ακολουθεί το συνηθισμένο μηχανισμό φωτοχημικής αλογόνωσης αλκανίων. Παράγονται και πολυχλωροπαράγωγα. Η συγκέντρωση των τελευταίων περιορίζεται με χρήση περίσσειας βουτανίου.
- Η αναφερόμενη στοιχειομετρική αναλογία παραγωγής χλωροβουτανίων δεν συνυπολογίζει τα συμπαραγόμενα πολυχλωροπαράγωγα.
- Η μέθοδος δεν είναι χρήσιμη αν επιθυμείται το ένα μόνο ισομερές, αφού είναι σχετικά δύσκολος διαχωρισμός.
Με υποκατάσταση υδροξυλίου από χλώριο
1. Με επίδραση υδροχλωρίου (HCl) σε 2-βουτανόλη (CH3CH2CH(OH)CH3)[4]:
2. Η υποκατάσταση του OH από Cl στην 2-βουτανόλη μπορεί να γίνει και με χλωριωτικά μέσα[5]:
- 1. Με πενταχλωριούχο φωσφόρο (PCl5):
- 2. Με τριχλωριούχο φωσφόρο (PCl3):
- 3. Με θειονυλοχλωρίδιο (SOCl2):
Με προσθήκη υδροχλωρίου σε 1-βουτένιο ή σε 2-βουτένιο
Με προσθήκη υδροχλωρίου σε 1-βουτένιο ή σε 2-βουτένιο παράγεται 2-χλωροβουτάνιο[6]::
ή
Με προσθήκη χλωρομεθανίου σε προπένιο
Με προσθήκη φθρορομεθανίου σε προπένιο παράγεται 2-χλωροβουτάνιο[7]::
Με προσθήκη υδροχλωρίου σε μεθυλοκυκλοπροπάνιο
Με προσθήκη υδροχλωρίου (ΗCl) σε μεθυλοκυκλοπροπάνιο παράγεται 2-χλωροβουτάνιο[8]:
Χημικές ιδιότητες και παράγωγα
Αντιδράσεις υποκατάστασης
- Οι αντιδράσεις είναι πολύ πιο αργές σε σύγκριση με τα αντίστοιχα αλκυλαλογονίδια των άλλων αλογόνων, γιατί ο μηχανισμός που επικρατεί σ' αυτές τις αντιδράσεις υποκαταστάσεως είναι ο SN2.
Υποκατάσταση από υδροξύλιο
Κατά την υδρόλυσή του με εναιώρημα υδροξειδίου του αργύρου (AgOH) σχηματίζεται 2-βουτανόλη (CH3CH2CH(OH)CH3)[9]:
Υποκατάσταση από αλκοξύλιο
Με αλκοολικά άλατα (RONa) σχηματίζει 2-αλκοξυβουτάνιο (CH3CH2CH(OR)CH3)[9]:
Υποκατάσταση από αλκινύλιο
Με αλκινικά άλατα (RC≡CNa) σχηματίζει αλκίνιο (RC≡CCH(CH3)CH2CH3). Π.χ.[9]:
Υποκατάσταση από ακύλιο
Με καρβονικά άλατα (RCOONa) σχηματίζει καρβονικό δευτεροταγή βουτυλεστέρα (RCOOCH(CH3)CH2CH3)[9]:
Υποκατάσταση από κυάνιο
Με κυανιούχο νάτριο (NaCN) σχηματίζει 2-μεθυλοβουτανονιτρίλιο (CH3CH2CH(CN)CH3)[9]:
Υποκατάσταση από αλκύλιο
Με αλκυλολίθιο (RLi) σχηματίζει αλκάνιο[9]:
Υποκατάσταση από σουλφυδρίλιο
Με όξινο θειούχο νάτριο (NaSH) σχηματίζει 2-βουτανοθειόλη (CH3CH2CH(SH)CH3)[9]:
Υποκατάσταση από σουλφαλκύλιο
Με θειολικό νάτριο (RSNa) σχηματίζει 2-αλκυλοθειοβουτάνιο (RSCH(CH3)CH2CH3)[9]:
Υποκατάσταση από ιώδιο
Με ιωδιούχο νάτριο (NaI) σχηματίζει 2-ιωδοβουτάνιο (CH3CH2CHICH3)[9]:
Υποκατάσταση από φθόριο
Με επίδραση φθοριούχου υφυδραργύρου (Hg2F2) σε 2-χλωροβουτάνιο (CH3CH2CHClCH3) παράγεται 2-φθοροβουτάνιο[10]:
Υποκατάσταση από αμινομάδα
Με αμμωνία (NH3) σχηματίζει 2-βουταναμίνη (CH3CH2CH(NH2)CH3)[9]:
Υποκατάσταση από αλκυλαμινομάδα
Με πρωυτοταγείς αμίνες (RNH2) σχηματίζει N-αλκυλο-2-βουταναμίνη (CH3CH2CH(NHR)CH3)[9]:
Υποκατάσταση από διαλκυλαμινομάδα
Με δευτεροταγείς αμίνες (R'NHR) σχηματίζει N,N-διαλκυλο-2-βουταναμίνη [(CH3CH2CH(NRR΄)CH3)][9]:
Υποκατάσταση από τριαλκυλαμινομάδα
Με τριτοταγείς αμίνες [R'N(R)R΄΄] σχηματίζει χλωριούχο N,N,N-τριαλκυλο(1-μεθυλοπροπυλ)αμμώνιο {[(CH3CH2CH(NRR΄R΄΄)CH3]Cl}[11]:
Υποκατάσταση από φωσφύλιο
Με φωσφίνη σχηματίζει 2-βουτανοφωσφαμίνη[12]:
Υποκατάσταση από νιτροομάδα
Με νιτρώδη άργυρο (AgNO2) σχηματίζει 2-νιτροβουτάνιο (CH3CH2CH(NO2)CH3)[13]:
Υποκατάσταση από φαινύλιο
Με επίδραση τύπου Clriedel-Crafts σε βενζολίου παράγεται 2-φαινυλοβενζόλιο:
Παραγωγή οργανομεταλλικών ενώσεων
1. Με λίθιο (Li σχηματίζει δευτεροταγές βουτυλολίθιο[14]:
2. Με μαγνήσιο (Mg) σχηματίζει δευτεροταγές βουτυλομαγνησιοχλωρίδιο [15]:
Αναγωγή
1. Με λιθιοαργιλλιοϋδρίδιο (LiAlH4) παράγεται βουτάνιο.[16]:
2. Με «υδρογόνο εν τω γενάσθαι», δηλαδή μέταλλο + οξύ παράγεται βουτάνιο.[17]:
3. Με σιλάνιο, παρουσία τριχλωριούχου βορίου, παράγεται βουτάνιο[18]:
4. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[19]:
Αντιδράσεις προσθήκης
1. Σε αλκένια. Π.χ. με αιθένιο (CH2=CH2) παράγει 3-μεθυλο-1-χλωροπεντάνιο [20]:
2. Σε αλκίνια. Π.χ. με αιθίνιο (HC≡CH) παράγει 3-μεθυλο-1-χλωρο-1-πεντένιο [21]:
3. Η αντίδραση του 1-χλωροβουτανίου με συζυγή αλκαδιένια αντιστοιχεί κυρίως σε 1,4-προσθήκη, αν και είναι επίσης δυνατές η 1,2-προσθήκη και η 3,4-προσθήκη, με τη χρήση κατάλληλων συνθηκών. Π.χ[22]:
(1,4-προσθήκη)
(1,2-προσθήκη)
(3,4-προσθήκη)
4. Σε κυκλοαλκάνια που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με κυκλοπροπάνιο παράγει 4-μεθυλο-1-χλωρεξάνιο[23]:
5. Σε ετεροκυκλικές ενώσεις που έχουν τριμελή ή τετραμελή δακτύλιο. Π.χ. με εποξυαιθάνιο παράγει δευτεροταγές βουτοξυ-2-χλωραιθάνιο[24]:
Αντίδραση απόσπασης
Με απόσπαση υδροχλωρίου (HCl) από 2-χλωροβουτάνιο παράγεται μίγμα από 1-βουτένιο και 2-βουτένιο[25]:
Παρεμβολή καρβενίων
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- 1. Παρεμβολή στους τρεις (3) δεσμούς C#1H2-H. Παράγεται 3-χλωροπεντάνιο.
- 2. Παρεμβολή στους τρεις (3) δεσμούς C#4H2-H. Παράγεται 2-χλωροπεντάνιο.
- 3. Παρεμβολή στους δυο (2) δεσμούς CH-H: Παράγεται 3-μεθυλο-2-χλωροβουτάνιο.
- 4. Παρεμβολή στον ένα (1) δεσμό C-H: Παράγεται 2-μεθυλο-2-χλωροβουτάνιο.
Προκύπτει επομένως μίγμα 3-χλωροπεντάνιου ~33%, 3-χλωροπεντάνιου ~33%, 3-μεθυλο-2-χλωροβουτάνιου ~22% και 2-μεθυλο-2-χλωροβουτάνιου ~11%.
Σημειώσεις και αναφορές
- ↑ Το #2 άτομο άνθρακα είναι οπτικά ενεργό κέντρο, αφού είναι συνδεμένο με τέσσερεις (4) διαφορετικές «ρίζες»: H, Cl, CH3, CH2CH3.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.2, R = CH3CH2CH2CH2, CH3CH2CHCH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.1, R = CH3CH2CHCH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.2, R = CH3CH2CHCH3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = Η και Nu = Cl.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = CH3 και Nu = Cl.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = Η και Nu = Cl σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 9,11 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2.8.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 243, §10.2.Α, R = CH3CH2CHCH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 267, §11.3.Α1, R = CH3CH2CHCH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, R = CH3CH2CHCH3, X = Cl.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, §5.1. σελ.82
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = CH3CH2CHCH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3α, R = CH3CH2CHCH3, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.3β, R = CH3CH2CHCH3, X = Cl.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, για Ε = CH3CH2CHCH3 και Nu = Cl.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκίνια και για Ε = CH3CH2CHCH3 και Nu = Cl με βάση και την §8.1, σελ. 114-116.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για αλκαδιένια και για Ε = CH3CH2CHCH3 και Nu = Cl με βάση και την §8.2, σελ. 116-117.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, §6.3., σελ. 79, εφαρμογή για κυκλοαλκάνια και για Ε = CH3CH2CHCH3 και Nu = Cl σε συνδυασμό με Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §1.2., σελ. 22-25
- ↑ Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985, §2.1., σελ. 16-17, εφαρμογή γενικής αντίδρασης για Nu = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Πηγές
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροχημικών Ενώσεων, Θεσσαλονίκη 1985
![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{3}+Cl_{2}{\xrightarrow[{\triangle }]{UV}0,28CH_{3}CH_{2}CH_{2}CH_{2}Cl+0,72CH_{3}CH_{2}CHClCH_{3}+HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/61eb726b8dbe2d1cd4643a5c641ef1d06dea81dc)





















![{\displaystyle \mathrm {CH_{3}CH_{2}CHClCH_{3}+R{\acute {}\;N(R)R{\acute {}\;{\acute {}\;{\xrightarrow {}[CH_{3}CH_{2}CH(N(R)(R{\acute {})R{\acute {}\;{\acute {})CH_{3}]Cl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6aa9a9034b8148a3115155dd74c45c47d6ac30d)



![{\displaystyle \mathrm {CH_{3}CH_{2}CHClCH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}CH_{3}CH_{2}CHLiCH_{3}+LiCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe461ceba6c6721201e3a9856df0c762fc8cb347)












![{\displaystyle \mathrm {CH_{3}CH_{2}CHClCH_{3}+NaOH{\xrightarrow[{\triangle }]{ROH}{\frac {3}{5}CH_{3}CH_{2}CH=CH_{2}+{\frac {2}{5}CH_{3}CH=CHCH_{3}+NaCl+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5334344c5786fcd42050d2c4c03bdd128d4b672)
