Βουτάνιο
| Βουτάνιο | |||
|---|---|---|---|

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Βουτάνιο | ||
| Άλλες ονομασίες | Διαιθύλιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C4H10 | ||
| Μοριακή μάζα | 58,12 g/mol | ||
| Σύντομος συντακτικός τύπος |
CH3CH2CH2CH3 | ||
| Συντομογραφίες | BuH, Et2 | ||
| Αριθμός CAS | 106-97-8 | ||
| SMILES | CCCC | ||
| InChI | 1/C4H10/c1-3-4-2/h3-4H2,1-2H3 | ||
| Αριθμός UN | 1011 | ||
| PubChem CID | 7843 | ||
| ChemSpider ID | 7555 | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Μεθυλοπροπάνιο | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -138,2 °C (134,95 K) | ||
| Σημείο βρασμού | -0,5 °C (272,65 K) | ||
| Πυκνότητα | 2,48 kg/m3 (15 °C) | ||
| Διαλυτότητα στο νερό |
61 g/m3 | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Βαθμός οκτανίου | 114[1] 89,6[2] | ||
| Βαθμός κετανίου | 22 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
-60 °C (213,15 K) | ||
| Σημείο αυτανάφλεξης | 405 °C (678,15 K) | ||
| Επικινδυνότητα | |||

| |||
| Εύφλεκτο | |||
| Φράσεις κινδύνου | R12 | ||
| Φράσεις ασφαλείας | S2, S9, S16 | ||
| MSDS | Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το (κανονικό) βουτάνιο[3][4] (αγγλικά butane) είναι οργανική χημική ένωση, με μοριακό τύπο C4H10 και ημισυντακτικό τύπο CH3(CH2)2CH3. Είναι μέλος της ομόλογης σειράς των αλκανίων με τέσσερα (4) άτομα άνθρακα. Το χημικά καθαρό βουτάνιο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι πολύ εύφλεκτο άχρωμο και άοσμο[5] αέριο. Αποτελεί το κύριο συστατικό του υγραερίου, προερχόμενο από διύλιση κλασμάτων του πετρελαίου, του φυσικού αερίου (ως 5%), των προϊόντων πυρόλυσης αυτών, καθώς και ανακυκλούμενων πολυμερών.
Ιστορία
Ανακαλύφθηκε από τον χημικό Έντουαρτ Φράνκλαντ (Edward Frankland) το 1849.
Ονοματολογία
Η ονομασία «βουτάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «βουτ-» δηλώνει την παρουσία τεσσάρων (4) ατόμων άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες με χαρακτηριστικές καταλήξεις, δηλαδή ότι είναι ένας υδρογονάνθρακας, αφού η ονομασία δεν αναφέρει χαρακτηριστικές ομάδες ούτε ως προθέματα.
Η ρίζα «βουτ-» προήλθε από το βουτανικό οξύ, που ονομάζεται εμπειρικά «βουτυρικό οξύ», που με τη σειρά του ονομάστηκε έτσι από την αντίστοιχη ελληνική λέξη βούτυρο, επειδή πράγματι έχει βρεθεί στο γάλα, ιδιαίτερα στο κατσικίσιο, στο πρόβειο και σε αυτό του βίσονα.
Ισομέρεια βουτανίων

Το βουτάνιο απαντάται σε δύο ισομερείς μορφές: το (κανονικό) n-βουτάνιο (CH3-CH2-CH2-CH3) που είναι ένας γραμμικός υδρογονάνθρακας, και το ισοβουτάνιο ή (2-)μεθυλοπροπάνιο (CH3-CH-(CH3)-CH3). Τα ισομερή αυτά παρόλο που έχουν ίδιο χημικό τύπο και μοριακό βάρος, έχουν διαφορετικές δομές και διαφορετικές ιδιότητες.
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό Βάρος |
Σημείο ζέσεως (°C, 1 atm) |
| (κ-)βουτάνιο βουτάνιο |
58,12 | -0,5 | |
 |
(2-)μεθυλοπροπάνιο ισοβουτάνιο |
58,12 | -11,7 |
Κατά IUPAC ο όρος βουτάνιο μπορεί να αναφέρεται μόνο στο («κανονικό») βουτάνιο, αλλά ενίοτε ο όρος μπορεί επίσης να χρησιμοποιείται για το ισοβουτάνιο [(2-)μεθυλοπροπάνιο κατά IUPAC], καθώς και σε μείγματα αυτών.
Δομή
Το μόριό του αποτελείται από τέσσερα (4) άτομα άνθρακα (δύο (2) πρωτοταγή[6] + δύο (2) δευτεροταγή[7]) και δέκα (10) άτομα υδρογόνου. Δομικά, το κάθε ακραίο άτομο άνθρακα βρίσκεται στο κέντρο ενός τετραέδρου και τα τρία (3) άτομα υδρογόνου και το έτερο άτομο άνθρακα στις κορυφές του. Για τα δύο (2) κεντρικά άτομα άνθρακα, η διαφορά είναι ότι το καθένα τους είναι συνδεμένο με δύο (2) άτομα υδρογόνου και δύο (2) άτομα άνθρακα Οι δεσμοί C-Η που σχηματίζονται είναι ελαφρά πολωμένοι (~3%) ομοιοπολικοί τύπου σ (2sp3-1s), με μήκος 108,7 pm. Ο δεσμός C-C είναι ομοιοπολικός τύπου σ (2sp3-2sp3), με μήκος 154 pm. Οι δε γωνίες HCH είναι περίπου 109° 28΄.
| Δεσμοί[8] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-C | σ | 2sp3-2sp3 | 154 pm | |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| C#1,#4 | -0,09 | |||
| C#2,#3 | -0,06 | |||
| H | +0,03 | |||
Παραγωγή
Απομόνωση από φυσικές και βιομηχανικές πηγές
- Απομονώνεται από το φυσικό αέριο (-5%).
- Απομονώνεται από το υγραέριο.
- Απομονώνεται από αέρια μείγματα που προκύπτουν από πυρόλυση προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Παρασκευή με αντιδράσεις σύνθεσης: Από πρώτες ύλες με μικρότερη ανθρακική αλυσίδα
1. Το βουτάνιο είναι συμμετρικό αλκάνιο, δηλαδή αποτελείται από δυο συμμετρικά τμήματα αιθύλιου (CH3CH2). Αυτό επιτρέπει τη παραγωγή του με τη μέθοδο Wurtz, από αιθυλαλογονίδια (CH3CH2X) και Na[9]:
2. Για τον ίδιο λόγο παράγεται και με ηλεκτρόλυση διαλύματος CH3CH2COONa[10]:
3. Είναι επίσης εύκολη η σύνθεση με αντίδραση αιθυλαλογονίδιου - αιθυλολίθιου[11]:
4. Ακόμη, το βουτάνιο μπορεί να ληφθεί με επίδραση νατρίου σε προπανονιτρίλιο (CH3CH2CN)[12]:
Παρασκευή με αντιδράσεις χωρίς αλλαγή ανθρακικής αλυσίδας
Με αναγωγή αλογονούχων ενώσεων
Αναγωγή 1-βουτυλαλογονιδίου (CH3CH2CH2CH2X) ή 2-βουτυλαογονιδίου (CH3CH2CHXCH3)[13]:
1. Με αναγωγή 1-βουτυλογονιδίου ή 2-βουτυλαογονιδίου από «υδρογόνο εν τω γεννάσθαι», δηλαδή μέταλλο + οξύ:
ή
2. Με αναγωγή 1-βουτυλογονιδίου ή 2-βουτυλαογονιδίου από LiAlH4 ή NaBH4[14]:
ή
3 Με αναγωγή 1-βουτυλιωδίδιου ή 2-βουτυλιωδιδίου από HI[15]:
ή
4. Με αναγωγή 1-βουτυλαλογονιδίου ή 2-βουτυλαλογονιδίου από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται βουτάνιo[16]:
ή
5. Αναγωγή από ένα αλκυλοκασσιτεράνιο. Π.χ.[17]:
ή
6. Με αναγωγή από μέταλλα και στη συνέχεια υδρόλυση των παραγόμενων οργανομεταλλικών ενώσεων:
[19]
ή
[21]
ή
Με υδρογόνωση ακόρεστων υδρογονανθράκων
1. 1-βουτενίου ή 2-βουτενίου[22][23]:
ή
2. 1-βουτίνιου ή 2-βουτίνιο[24]:
ή
3. 1,2-βουταδιενίου ή 1,3-βουταδιενίου[23]:
ή
6. Βουταδιίνιου[24]:
Με αναγωγή οξυγονούχων ενώσεων
1. Με αναγωγή βουτανάλης- Αντίδραση Wolf-Kishner[26]
2. Με αναγωγή βουτανόνης - Αντίδραση Clemmensen[27]:
Με αναγωγή θειούχων ενώσεων
1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί βουτάνιο. Π.χ. από την αναγωγή της 1-βουτανοθειόλης (μέθοδος Raney)[28]:
2. Με αναγωγή των κατάλληλων θειεστέρων μπορεί να παραχθεί βουτάνιο. Π.χ. από την αναγωγή του διβουτυλοθειαιθέρα (μέθοδος Raney)[28]:
Παρασκευή με αντιδράσεις αποσύνθεσης με μείωση του μήκους της ανθρακικής αλυσίδας
- Με τη θέρμανση αΛκαλικού διαλύματος πεντανικού οξέος (CH3CH2CH2CH2COOH) ή 2-μεθυλοπροπανικού οξέος [CH3CH2CH(CH3)COOH][29]:
ή
Φυσικές ιδιότητες
Το n-βουτάνιο είναι άχρωμο και εξαιρετικά εύφλεκτο αέριο. Είναι μία εξαιρετικά σταθερή χημική ένωση, χωρίς καμία διαβρωτική δράση στα μέταλλα. Ελάχιστα διαλυτό στο νερό, αλλά πολύ διαλυτό στις αλκοόλες, τους αιθέρες και το χλωροφόρμιο.[30]
Χημικές ιδιότητες
Οξείδωση
Καύση
Το βουτάνιο αντιδρά με το οξυγόνο και καίγεται παράγοντας γαλαζωπή φλόγα υψηλής θερμοκρασίας[31]:
- Αν και η αντίδραση είναι μια έντονα εξώθερμη δεν συμβαίνει σε μέτριες θερμοκρασίες, γιατί για την έναρξή της πρέπει να υπερπηδηθεί πρώτα το εμπόδιο της διάσπασης των δεσμών C-C[32], των δεσμών C-H[33] και των δεσμών (Ο=Ο)[34] του O2:
Αν το διαθέσιμο για την καύση οξυγόνο είναι περιορισμένο, έχουμε «ατελή καύση»:
Η μέγιστη θερμοκρασία αδιαβατικής φλόγας από βουτάνιο και αέρα είναι 1.970°C.
Παραγωγή υδραερίου
Καταλυτική οξυγόνωση
Παράγεται (κυρίως) βουτανόνη:
Αντίδραση με διοξιράνιο
Το βουτάνιο οξειδώνεται από το διοξιράνιο, παράγοντας (κυρίως) βουτανόνη:
Οξείδωση προς μηλεϊνικό ανυδρίτη
Ακόμη, αξιοποιείται βιομηχανικά και η οξείδωση του βουτανίου προς μηλεϊνικό ανυδρίτη (διεργασία Ντουπόντ, DuPont's catalytic process):
Αλογόνωση
Φωτοχημική[35]
- Δραστικότητα των X2: F2 > Cl2 > Br2 > Ι2.
- όπου 0<x<1 διαφέρει ανάλογα με το αλογόνο:
- Τα F και Cl είναι πιο δραστικά και λιγότερο εκλεκτικά. Η αναλογία των προπυλαλογονιδίων τους εξαρτάται κυρίως πό τη στατιστική αναλογία των προς αντικατάσταση ατόμων H. Ειδικά γοα το χλώριο θα έχουμε:
- 1-χλωροβουτάνιο: 6•1 = 6
- 2-χλωροβουτάνιο: 4•3,8=15,2
- Δηλαδή το μείγμα που προκύπτει είναι: 28% 1-χλωροβουτάνιο και 72% 2-χλωροβουτάνιο.
- Τα Br και I είναι πιο εκλεκτικά και λιγότερο δραστικά. Η αναλογία των βουτυλαλογονιδίων μεταβάλλεται προς όφελος του βουτυλοαλογονίδιου-2. Ειδικα για το βρώμιο θα έχουμε:
- 1-βρωμοβουτάνιο: 6•1 = 6
- 2-βρωμοβουτάνιο: 4•82=328
- Δηλαδή το μείγμα που προκύπτει είναι: 2% 1-βρωμοβουτάνιο και 98% 2-βρωμοβουτάνιο.
- Ανάλυση του μηχανισμού της χλωρίωσης του CH3CH2CH2CH3:
- 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
- Η απαιτούμενη ενέργεια προέρχεται από το υπεριώδες φως (UV) ή θερμότητα (Δ).
- 2. Διάδοση: Καταναλώνονται οι παλιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους οι ελεύθερες ρίζες, κατά τη στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο να σταματήσει η αντίδραση στην παραγωγή CH3CH2CH2CH2X κσι CH3CH2CHXCH3.
- Αν χρησιμοποιηθούν ισομοριακές ποσότητες CH3CH2CH2CH3 και Χ2 θα παραχθεί μείγμα όλων των X-παραγώγων του CH3CH2CH2CH3
- Αν όμως χρησιμοποιηθει περίσσεια CH3CH2CH2CH3, τότε η απόδοση τωμ μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστική πιθανότητας συνάντισης CH3CH2CH2CH3 με X. σε σχέση με την πιθανότητα συνάντισης μονοπαραγώγου και X., που μπορεί να οδηγήσει στην παραγωγή των υπόλοιπων X-παραγώγων.
Περιφθορίωση
Το βουτάνιο αντιδρά με το τριφθοριούχο κοβάλτιο, αντικαθιστώντας όλα τα άτομα υδρογόνου με άτομα φθορίου, παράγοντας έτσι δεκαφθοροβουτάνιο[37]:
Παρεμβολή καρβενίων
- Η αντίδραση είναι ελάχιστα εκλεκτική και αυτό σημαίνει ότι κατά προσέγγιση έχουμε;
- 1. Παρεμβολή στους έξι (6) δεσμούς CH2-H: Παράγεται πεντάνιο.
- 2. Παρεμβολή στους δυο (4) δεσμούς CH-H: 4. Παράγεται μεθυλοβουτάνιο ή ισοπεντάνιο.
Προκύπτει επομένως μείγμα πεντανίου ~60% και μεθυλοβουτάνιου ~40%.
Νίτρωση
όπου 0<a,b<1, a + b = 1.
Καταλυτική ισομερείωση
Το n-βουτάνιο μπορεί να υποστεί αντίδραση ισομερειώσεως προς ισοβουτάνιο:[40]
Καταλυτική αφυδρογόνωση
Το κύριο προϊόν καταλυτικής αφυδρογόνωσης βουτανίου είναι το 1,2-βουταδιένιο:
Εφαρμογές

Η κυριότερη και πιο γνωστή χρήση του n-βουτανίου είναι ως καύσιμο, τόσο ως πρόσθετο στη βενζίνη, όσο και σε μείγματα υγραερίου. Όταν αναμιγνύεται με προπάνιο και άλλους υδρογονάνθρακες, μπορεί να αναφέρεται εμπορικά ως LPG, ακρωνύμιο των αγγλικών λέξεων Liguified Petrol Gas. Το υγραέριο, λόγω και της καθαρής καύσης του, έχει ευρεία χρήση στον οικιακό τομέα, στη βιομηχανία, στον αγροτικό τομέα, στον τουριστικό τομέα ακόμα και ως καύσιμο οχημάτων. Εκτός από βουτάνιο, το υγραέριο που πωλείται στο εμπόριο περιέχει σε μικρότερες ποσότητες προπάνιο (~20%) και ακόμη μικρότερες ποσότητες άλλων ουσιών, όπως ακόρεστο προπάνιο (προπένιο) και ακόρεστο βουτάνιο (βουτένιο), καθώς και ίχνη από ελαφρύτερους και βαρύτερους υδρογονάνθρακες (αιθάνιο, μεθάνιο, πεντάνιο και άλλα). Πωλείται σε υγρή μορφή, είτε σε δεξαμενές είτε σε φιάλες υπό πίεση ή ακόμα σε μικρότερα φιαλίδια που είναι εύκολα στη μεταφορά και τη χρήση.[41]
Πολύ καθαρές μορφές βουτανίου, αν και περισσότερο για το σκοπό αυτό προτιμάται το ισομερές μεθυλοπροπάνιο, χρησιμοποιούνται ως ψυκτικό υγρό, αντικαθιστώντας τα επικίδυνα για το στρατοσφαιρικό στρώμα του όζοντος αλομεθάνια. Χρησιμοποιήθηκε σε οικιακά ψυγεία και καταψύκτες. Η πίεση λειτουργίας των συσκευών αυτών για το βουτάνιο είναι μικρότερη από εκείνη των αλοβουτανίων, όπως του R-12, οπότε τα αντίστοιχα συστήματα κλιματισμού αυτοκινήτων, αν μετατραπούν σε συστήματα βουτανίου δε θα λειτουργούν σωστά.
Το βουτάνιο χρησιμοποιείται επίσης ως καύσιμο για αναπτήρες ή πυρσούς βουτανίου και πωλείται εγκλεισμένο σε δοχεία καυσίμου για μαγείρευμα ή και κατασκήνωση. Σε αυτήν τη μορφή συνήθως αναμιγνύεται με μικρές ποσότητες υδροθείου και θειολών, ως οσμοθέτες, επειδή το ίδιο το βουτάνιο είναι άοσμο, ώστε να γίνεται αντιληπτή, με την ανθρώπινη όσφρηση, τυχόν διαρροή του. Αν και οι δυο αναφερόμενοι οσμοθέτες θεωρούνται δηλητηριώδεις, έχουν χαμηλές θερμοκρασίες βρασμού και γρήγορα εξατμίζονται και διασκορπίζονται στον αέρα, όταν δεν βρίσκονται υπό πίεση. Το περισσότερο εμπορικά διαθέσιμο βουτάνιο περιέχει επίσης μικρές ποσότητες ελαίων, που μπορούν να αφαιρεθούν με διήθηση, διαφορετικά αφήνουν κατάλοιπα στα σημεία τις καύσης, που σταδιακά να παρεμποδίζουν τη ροή του υγραερίου.
Έχουν κατασκευασθεί, ακόμη, ασύρματες μασιές μαλλιών, που τροφοδοτούνται με βουτάνιο από ειδικά δοχεία[42].
Για τρόφιμα συσκευασμένα σε δοχεία αεροζόλ έχει κωδικό αριθμό Ε943α.
Χρησιμοποιείται, ακόμη, ως πρόδρομη ύλη για την παραγωγή πετροχημικών προϊόντων, μέσω πυρόλυσης με ατμό, πιο συγκεκριμένα για παραγωγή αιθενίου και 1,3-βουταδιενίου. Το τελευταίο (το 1,3-βουταδιένιο) είναι νευραλγικής σημασίας συστατικό των συνθετικών ελαστικών[43][44][45][46]. Χρησιμοποιείται, ακόμη ως καύσιμο για αναπτήρες και ως προωθητικό αερολυμάτων (αεροζόλ), όπως τα αποσμητικά[47].
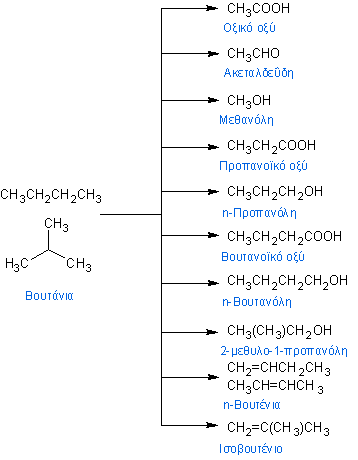
Τέλος, το n-βουτάνιο χρησιμοποιείται και ως πρώτη ύλη για την παραγωγή μιας πλειάδας οργανικών ενώσεως όπως το οξικό οξύ, το μαλεϊκό οξύ, η μεθανόλη, προπανόλη και βουτανόλη, προπανοϊκό και βουτανοϊκό οξύ και άλλες.[48]
Ασφάλεια - Υγεία
Η εισπνοή βουτανίου μπορεί να προκαλέσει ευφορία, υπνηλία, νάρκωση, ασφυξία, καρδιακή αρρυθμία, διακυμάνσεις στην πίεση του αίματος, προσωρινή απώλεια μνήμης και κρυοπαγήματα, φθάνοντας να προακλέσει ως αποτέλεσμα ακόμη και το θάνατο από ασφυξία και κοιλιακή μαρμαρυγή. Το βουτάνιο είναι πιο συχνά χρησιμοποιούμενη πτητική ουσία στο ΗΒ, έχοντας προκαλέσει το 52% των σχετικών θανάτων από διάλυμα το 2000[49]. Ψεκάζοντας με βουτάνιο απευθείας μέσα στο λάρυγγα, το ρεύμα του ρευστού μπορεί να ψύξει την περιοχή απότομα ως και τους −20 °C, λόγω απότομης εκτόνωσης, προκαλώντας παρατεταμένο λαρυγγοσπασμό[50]. Το «σύνδρομο αιφνιδίου θανάτου από εισπονή» (Sudden sniffer's death" syndrome), που περιγράφηκε για πρώτη φορά από τον Μπας (Bass) το 1970[51], είναι η πιο συνηθισμένη αιτία θανάτου από διάλυμα, με αποτέλεσμα να αποτελεί το 55% των αντίστοιχων γνωστών θανατηφόρων περιπτώσεων[50].
Επιπλέον, μικρή ποσότητα διοξειδίου του αζώτου (NO2), που είναι τοξικό αέριο, παράγεται, επίσης, κατά την καύση βουτανίου στον αέρα, και αποτελεί κίνδυνο βλάβης της ανθρώπινης υγείας από οικιακές θερμάνσεις και εστίες μαγειρεύματος[52].
Το n-βουτάνιο είναι ένα εξαιρετικά εύφλεκτο και πτητικό υλικό το οποίο πρέπει να αποθηκεύεται σε καλά αεριζόμενο μέρος και μακριά από πηγές ανάφλεξης.[53]
Αναφορές και σημειώσεις
- ↑ [1][νεκρός σύνδεσμος]
- ↑ API Data Book Values, APIDATA.XLS
- ↑ Το πρόθεμα κανονικό ή οι συντομογραφίες του κ- ή n- μπαίνουν απλά για λόγους έμφασης στην κανονικότητά του, δηλαδή στο γεγονός ότι έχει μη διακλαδισμένη ανθρακική αλυσίδα. Δεν είναι όμως απαραίτητο, γιατί και η μόνη η απουσία προθέματος που να δείχνει διακλάδωση, αρκεί για να δηλώσει το συγκεκριμένο ισομερές.
- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ Συνήθως όμως προστίθενται σε αυτό οσμοθέτες, όπως η αιθανοθειόλη, για να είναι ευκολότερα αντιληπτή μια τυχούσα διαρροή του, και να αποφεύγονται έτσι ατυχήματα.
- ↑ Άτομο C ενωμένο με ένα (1) άλλο άτομο C.
- ↑ Άτομο C ενωμένο με δύο (2) άλλα άτομα C.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, R = CH3CH2
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3b, R = CH3CH2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, R = CH3CH2, X = CN
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.1β., με R = CH3CH2CH2CH2 ή CH3CH2CHCH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, §6.2.1α., με R = CH3CH2CH2CH2 ή CH3CH2CHCH3
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.14, §1.1
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ.80-82, §5.1-5.2
- ↑ όπου |Εt2Ο| : άνυδρος διαιθυλαιθέρας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4α., με R = CH3CH2CH2CH2 ή CH3CH2CHCH3
- ↑ αντιδρασήριο Grignard
- ↑ cis- και trans-
- ↑ 23,0 23,1 23,2 23,3 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.5.
- ↑ 24,0 24,1 24,2 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ 25,0 25,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 160, §6.11.1
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6α, R = CH3CH2, R' = CH3
- ↑ 28,0 28,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α., με R = CH3CH2CH2CH2 ή CH3CH2CHCH3
- ↑ «The Molecule of the Month - October, 2004». Αρχειοθετήθηκε από το πρωτότυπο στις 25 Σεπτεμβρίου 2008. Ανακτήθηκε στις 27 Σεπτεμβρίου 2006.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1, v = 4 και μετατροπή μονάδας ενέργειας σε kJ.
- ↑ ΔHC-C= +347 kJ/mol
- ↑ ΔHC-H = +415 kJ/mol
- ↑ ΔHO-O=+146 kJ/mol
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.1β., με R = CH3CH2CH2CH2 ή CH3CH2CHCH3
- ↑ καθοριστικό ταχύτητας
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 185, §7.2β, ν = 4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3, R = CH3CH2CH2CH2 ή CH3CH2CHCH3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2, R = CH3CH2CH2CH2 ή CH3CH2CHCH3.
- ↑ Η ζήτηση του κανονικού βουτανίου συνήθως είναι μικρότερη από την προσφορά ενώ το αντίθετο συμβαίνει με το ισοβουτάνιο. Αποτέλεσμα αυτού είναι η παραπάνω αντίδραση να έχει γίνει πολύ σημαντική για την παραγωγή του ισοβουτανίου και την εκμετάλλευση του πλεονάζοντος n-βουτανίου.Enterprise Products Partners - Butane isomerization. Αρχειοθετήθηκε 2006-10-04 στο Wayback Machine.
- ↑ «Πληροφορίες για το υγραέριο από την Shell». Αρχειοθετήθηκε από το πρωτότυπο στις 19 Μαΐου 2006. Ανακτήθηκε στις 27 Σεπτεμβρίου 2006.
- ↑ FAA: Hazardous Materials p. 4
- ↑ MarkWest Energy Partners, L.P. Form 10-K. Sec.gov
- ↑ Copano Energy, L.L.C. Form 10-K. Sec.gov. Retrieved on 2012-12-03.
- ↑ Targa Resources Partners LP Form10-k. Sec.gov. Retrieved on 2012-12-03.
- ↑ Crosstex Energy, L.P. FORM 10-K. Sec.gov
- ↑ A Primer on Gasoline Blending. An EPRINC Briefing Memorandum
- ↑ 1.Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- ↑ Field-Smith M, Bland JM, Taylor JC, et al. "Trends in death Associated with Abuse of Volatile Substances 1971–2004". Department of Public Health Sciences. London: St George’s Medical School.
- ↑ 50,0 50,1 Ramsey J, Anderson HR, Bloor K, et al. (1989). "An introduction to the practice, prevalence and chemical toxicology of volatile substance abuse". Hum Toxicol 8 (4): 261–269. doi:10.1177/096032718900800403. PMID 2777265.
- ↑ Bass M. (1970). "Sudden sniffing death". JAMA 212 (12): 2075–2079. doi:10.1001/jama.1970.03170250031004. PMID 5467774.
- ↑ Ghosn, Marwan; Flouty, Roula; Saliba, Najat A. (2005). "Emission of Nitrogen Dioxide from Butane Gas Heaters and Stoves Indoors". American Journal of Applied Sciences 2 (3): 707. doi:10.3844/ajassp.2005.707.710.
- ↑ «Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.». Αρχειοθετήθηκε από το πρωτότυπο στις 14 Ιουνίου 2007. Ανακτήθηκε στις 27 Σεπτεμβρίου 2006.
Πηγές
- Τοξικολογική εκτίμηση βουτανίου.
- Hazard Summary on Butane.
- Energy Density of Butane.
- Στερεοχημική ισομέρεια διαμόρφωσης βουτανίου.
- Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
- Enterprise Products Partners - Butane isomerization.
- Πληροφορίες για το υγραέριο από την Shell.
- The Molecule of the Month - October, 2004.
- Παπαγεωργίου Β.Π., “Εφαρμοσμένη Οργανική Χημεία: Άκυκλες Ενώσεις”, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Μερικές από τις ενέργειες αντιδράσεων υπολογίστηκαν με χρήση κατάλληλου λογισμικού. Θα διασταυρωθούν και βιβλιογραφικά το συντομότερο για μεγαλύτερη ακρίβεια.
|
















![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{2}X+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}CH_{3}CH_{2}CH_{2}CH_{2}Li+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/13a3bc02e21ecb95a25c0eb21ff1c1f1b2d32724)

![{\displaystyle \mathrm {CH_{3}CH_{2}CHXCH_{3}+2Li{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}CH_{3}CH_{2}CHLiCH_{3}i+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ad18c7126d6182a0e413a5024c69bfbe8f062ef)























![{\displaystyle \mathrm {C_{4}H_{10}+4H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}4CO+9H_{2} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/32e12e10ed6e23b4a26478869355d1345eb0be3e)
![{\displaystyle \mathrm {C_{4}H_{10}+O_{2}{\xrightarrow[{\triangle }]{Cu}CH_{3}CH_{2}COCH_{3}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/66f00f3512b1dff1ad67e2c8a7e8b087d07e9246)



![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{3}+X_{2}{\xrightarrow[{\triangle }]{UV}xCH_{3}CH_{2}CH_{2}CH_{2}X+(1-x)CH_{3}CH_{2}CHXCH_{3}+HX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/18ae6340986a1c9ceb4b498e5375d985e2bef6e8)
![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)












![{\displaystyle \mathrm {CH_{3}CH_{2}CH_{2}CH_{3}{\xrightarrow[{Pd,Pt}]{\triangle }CH_{2}=CHCH=CH_{2}+2H_{2} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ef0c16c711463527029e22d44a15962bd0afe8c1)