Linfocitos T de memoria
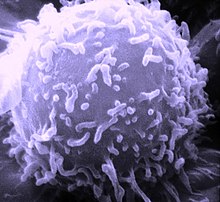
Los linfocitos T de memoria son un subtipo de linfocitos T importantes en la respuesta inmunitaria adaptiva. Comparten morfología con el resto de células T: una membrana con protuberancias de aspecto redondeado que rodea al citoplasma, ocupado en su mayor parte por un gran núcleo. Pueden distinguirse de otras poblaciones de linfocitos T mediante los marcadores de membrana CD44 o CD45 y su actividad citotóxica en ensayos in vitro. Se generan tras una infección primaria y son los encargados de mediar la defensa en infecciones sucesivas del mismo patógeno. Constituyen el principal factor al que se debe el éxito de la vacunación al generarse tras la exposición inicial al antígeno que se proporciona inactivado en la mayoría de vacunas. Además también tienen efecto contra células cancerígenas.[1]
Generación

Inicialmente los linfocitos T vírgenes procedentes de los órganos linfoides primarios (médula ósea y timo) migran a los órganos linfáticos secundarios (ganglios linfáticos) donde se encuentran con los antígenos presentados por las células presentadoras. Se produce la activación inicial y expansión clonal. Una vez diferenciadas, las células migran a los tejidos infectados donde al eliminar el patógeno mueren por apoptosis. Sin embargo, un remanente del 5% aproximadamente se mantiene como células de memoria. A pesar de haber muerto la mayoría, el número final de células específicas por el antígeno en cuestión es de entre 1 y 2 órdenes de magnitud más numerosas que las células vírgenes existentes inicialmente.[2] El ratio de células efectoras y de memoria que se generan ante la presencia del antígeno está directamente relacionado con la frecuencia y duración de estimulación en el TCR. Con una estimulación corta durante la infección primaria se generan principalmente células efectoras, mientras que si este estímulo se repite o es más duradero se generan células de memoria.[3]
Vida media
Las células T de memoria se caracterizan por poseer una larga vida media. En un estudio que buscaba calcular su duración se miró la respuesta que generaban distintas personas, inmunizadas en su infancia con la vacuna de la viruela, cuando ésta se le volvía a administrar. La clave estaba en que puesto que es una enfermedad erradicada, es imposible que la hayan sufrido y la memoria generada será una memoria verdadera y no una memoria generada por re-estimulación periódica con el antígeno. Se vio que incluso 75 años después de la inmunización original se generaba una respuesta, la cual se calculó que tiene una vida media de 15 años por medida de su intensidad.[4] Uno de los factores que contribuyen a su prolongada supervivencia es la expresión de grandes cantidades de proteínas antiapoptóticas como Bcl-2 y Bcl-XL que bloquean la muerte celular que tienen programada. Con esto pueden sobrevivir incluso tras la desaparición de las señales de supervivencia y proliferación que se generan en presencia del antígeno.
Acciones
Tienen la capacidad de mediar respuestas rápidas y potentes (conocidas como respuestas secundarias) contra futuras exposiciones a los antígenos. Mientras que una respuesta primaria puede tardar de 5 a 7 días en producirse, la respuesta secundaria tarda solamente entre 1 y 3 días. Además tienen un umbral de respuesta más bajo que los linfocitos T vírgenes (que solo responden ante una gran cantidad de antígeno). Esta superioridad funcional es debida en gran parte a cambios en el patrón de expresión inducidos por cambios epigenéticos (metilación de DNA, modificaciones de histonas o reorganización de la estructura de la cromatina) en algunas moléculas importantes en la respuesta inmune como la perforina.[5] Además, contrariamente a los linfocitos T vírgenes que están localizados prácticamente de forma exclusiva en los tejidos linfoides, pueden encontrarse en tejidos no linfoides (mucosas principalmente) para poder atacar al patógeno con mayor rapidez.[6] Pueden mantenerse en estado inactivo (sin estimulación por el antígeno) durante años e incluso exhiben una baja capacidad de auto-renovación. Este hecho provoca que a lo largo de la vida de un ser humano, al estar continuamente expuestos a diferentes antígenos, se acumulen las células memoria y aumenten su proporción comparada con la de células vírgenes. Así en personas mayores de 50 años la mitad o más de los linfocitos T circulantes pueden ser células memoria.
Citocinas implicadas

Inicialmente para su activación y expansión clonal las células vírgenes necesitan de la IL-2 y la IL-15 proporcionada por las células dendríticas durante la presentación del antígeno. Una vez las células efectoras realizan su función, la mayoría mueren por apoptosis. Sin embargo, pueden evitarlo mediante citocinas de supervivencia que además median su transformación a célula de memoria. La más importante de ellas es la IL-7[7] secretada de forma constitutiva por las células estromales, lo que explica la alta concentración de su receptor (CD127) en la superficie; pero también interviene la IL-15. Ambas citocinas estimulan la expresión de proteínas antiapoptóticas e inducen una ligera proliferación.[8]
Tipos
Memoria central (TCM)
La memoria central o TCM (del inglés T central memory cells) se reconoce principalmente mediante los marcadores CD62L+ y CCR7+. En estado basal se alojan en órganos linfoides secundarios (ganglios linfáticos y bazo principalmente). De entre todos los tipos de células son las que poseen la capacidad más limitada para realizar funciones efectoras ya que son las que más se han diferenciado; a pesar de que expresan rápidamente el ligando CD40 (marcador de activación temprana), tardan más tiempo en re-diferenciarse a células T efectoras que se enfrenten al patógeno. Poseen una respuesta proliferativa muy rápida y potente ya que en cuestión de días generan muchas células efectoras. Son las únicas en producir IL2 al ser estimuladas (además del IFN-γ y TNF-α que producen también los otros subtipos). Esta IL-2 es esencial para la respuesta inmune ya que induce la proliferación linfocitaria e interviene en la reacción inflamatoria estimulando la generación de otras citocinas esenciales en la respuesta como IFN-γ, IL-1, TNF-α y TNF-β.
Memoria efectora (TEM)
La memoria efectora o TEM (del inglés T effector memory cells) puede identificarse en inmunología por ser la población de células memoria con los marcadores CD62L-, CCR7-. En estado basal se encuentran en tejidos periféricos, en especial mucosas, y recircularizando por la sangre y linfa. Tiene alta cantidad de integrinas β1 y β2 lo que le permite entrar rápidamente en los tejidos inflamados. Pueden expresar los receptores de citocinas típicos de TH1 como CCR5 o de TH2 como CCR4. Al ser estimulada se activa rápidamente produciendo IFN-γ, IL4 e IL5. Su principal modo de actuación se basa en que posee una alta actividad citolítica, ya que a diferencia de la memoria central no prolifera mucho. En contexto antitumoral, son mucho peores que las TCM ya que a pesar de que desarrolla las funciones efectoras más rápidamente, éstas son mucho menos potentes.[9]
Memoria residente (TRM)
La memoria residente o TRM (del inglés T resident memory cells) ha sido el último grupo en ser descubierto y clasificado.[10] Se caracterizan por los marcadores CD69+ y CD103+, la expresión de E-selectina y P-selectina y la producción de IFN-γ y TNF-α.[11] Se encuentran siempre recluidas en el tejido donde ocurrió la infección primaria ya que no recircularizan (han perdido la capacidad migratoria). Esta característica, que las diferencia del resto de células linfoides, se demostró mediante experimentos de parabiosis.[12] Derivan de los mismos precursores del resto de células memoria[13] o a partir de TEM cuando migran a tejidos inflamados por gradiente de citocinas. Una vez allí activan la expresión de integrinas que le permiten interaccionar con la matriz extracelular y apagan la expresión de receptores de regreso para evitar la migración fuera del tejido. La supervivencia de las TRM puede asegurarse mediante factores de crecimiento liberados por las células del tejido colindante. Controlan la invasión de patógenos de forma más eficiente que la TCM debido a su localización y sus capacidades. Además están en una mayor concentración en el tejido en comparación a las TCM en sangre. Median las respuestas rápidas de hipersensibilidad, a diferencia de las TCM que llevan a cabo respuestas más lentas y atenuadas. Se ha visto que por sí solas son necesarias y suficientes para la protección contra una infección cutánea. En experimentos donde se escarificaban ratones tratados con FTY720 (molécula que retira las TCM de la circulación) con virus vaccinia.[14]
Marcadores de membrana
Algunos son comunes al linaje mientras que otros varían entre los distintos subtipos.[15] Son comúnmente utilizados en inmunología para diferenciar a las distintas subpoblaciones.
| Marcador | TCM | TEM | TRM | Función |
|---|---|---|---|---|
| CXCR5 (CD185) | Baja | Baja | Baja | GPCR implicado en la migración de células B a los tejidos infectados |
| CCR7 (CD197) | Alta | Baja | Baja | Migración de TCM a los órganos linfoides secundarios para estimular la maduración de células dendríticas |
| CD25 | Baja | Baja | Baja | Cadena α del receptor de la IL2 |
| CD27 | Alta | Media | Media | Receptor de TNF |
| CD44 | Alta | Alta | Alta | Glicoproteína implicada en adhesión y migración |
| CD45 | Alta | Alta | Alta | Tirosina fosfatasa que media crecimiento, diferenciación y multiplicación |
| CD62L | Alta | Baja | Baja | Selectina L. Actúa como receptor de migración a los órganos linfoides secundarios |
| CD69 | Baja | Baja | Alta | Lectina expresada tras la activación de linfocitos |
| CD127 | Alta | Alta | Alta | Cadena α del receptor de la IL7 |

Referencias
- ↑ Schirrmacher, Volker (1899). «Cancer-reactive memory T cells from bone marrow: Spontaneous induction and therapeutic potential (Review)». International Journal of Oncology. doi:10.3892/ijo.2015.3197.
- ↑ Gourley, Tania S.; Wherry, E. John; Masopust, David (octubre de 2014). «Generation and maintenance of immunological memory». Seminars in Immunology. Immunological Memory 16: 323–333. doi:10.1016/j.smim.2004.08.013.
- ↑ Kalia, Vandana; Sarkar, Surojit; Gourley, Tania S; Rouse, Barry T; Ahmed, Rafi (junio de 2006). «Differentiation of memory B and T cells». Current Opinion in Immunology. Lymphocyte activation / Lymphocyte effector functions 18: 255–264. doi:10.1016/j.coi.2006.03.020.
- ↑ Demkowicz, W E; Littaua, RA; Wang, J; Ennis, F A (abril de 1996). «Human Cytotoxic T-Cell Memory: Long-Lived Responses to Vaccinia Virus.». Journal of Virology. 70 (4): 2627–2631.
- ↑ Wilson, Christopher B; Makar, Karen W; Shnyreva, Maria; Fitzpatrick, David R (abril de 2005). «DNA methylation and the expanding epigenetics of T cell lineage commitment». Seminars in Immunology. Gene Silencing in Lymphocyte Development 17 (2): 105–119. doi:10.1016/j.smim.2005.01.005.
- ↑ Masopust, David; Vezys, Vaiva; Marzo, Amanda L.; Lefrançois, Leo (marzo de 2001). «Preferential Localization of Effector Memory Cells in Nonlymphoid Tissue». Science 291 (5512): 2413–2417. PMID 11264538. doi:10.1126/science.1058867.
- ↑ Schluns, Kimberly S.; Lefrançois, Leo (abril de 2003). «Cytokine control of memory T-cell development and survival». Nature Reviews Immunology 3 (4): 269–279. doi:10.1038/nri1052.
- ↑ Goldrath, Ananda W.; Sivakumar, Pallavur V.; Glaccum, Moira; Kennedy, Mary K.; Bevan, Michael J.; Benoist, Christophe; Mathis, Diane; Butz, Eric A. (junio de 2002). «Cytokine Requirements for Acute and Basal Homeostatic Proliferation of Naive and Memory CD8+ T Cells». The Journal of Experimental Medicine 195 (12): 1515–1522. PMID 12070279. doi:10.1084/jem.20020033.
- ↑ Klebanoff, Christopher A.; Gattinoni, Luca; Torabi-Parizi, Parizad; Kerstann, Keith; Cardones, Adela; Finkelstein, Steven E.; Palmer, Douglas C.; Antony, Paul A.; Hwang, Sam T.; Rosenberg, Steven A.; Waldmann, Thomas A.; Restifo, Nicholas P. (24 de junio de 2005). «Central memory self/tumor-reactive CD8+ T cells confer superior antitumor immunity compared with effector memory T cells». PNAS 102 (27): 9571-9576. PMID 15980149. doi:10.1073/pnas.0503726102.
- ↑ Shin, H.; Iwasaki, A. (September 1, 2013). «Tissue-resident memory T cells.». Immunol Rev. 255 (1): 165-181. doi:10.1111/imr.12087.
- ↑ Jiang, Xiaodong; Clark, Rachael A.; Liu, Luzheng; Wagers, Amy J.; Fuhibrigge, Robert C.; Kupper, Thomas S. (8 de marzo de 2012). «Skin infection generates non-migratory memory CD8+ TRM cells providing global skin immunity». Nature 483: 227-231. doi:10.1038/nature10851.
- ↑ likima, Norifumi; Iwasaki, Akiko (septiembre de 2015). «Tissue instruction for migration and retention of TRM cells». Cell 36 (9): 556-564. doi:10.1016/j.it.2015.07.002.
- ↑ Gaide, Olivier; Emerson, Ryan O; Jiang, Xiadong; Gulati, Nicholas; Nizza, Suzanne; Desmarais, Cindy; Robins, Harlan; Krueger, James G; Clark, Rachael A; Kupper, Thomas S (11 de mayo de 2015). «Common clonal origin of central and resident memory T cells following skin immunization». Nature medicine 21: 647-653. doi:10.1038/nm.3860.
- ↑ Liu, Luzheng; Zhong, Qiong; Tian, Tian; Dubin, Krista; Athale, Shruti K; Kupper, Thomas S (17 de enero de 2010). «Epidermal injury and infection during poxvirus immunization is crucial for the generation of highly protective T cell–mediated immunity». Nature Medicine 16: 224-227. doi:10.1038/nm.2078.
- ↑ Sallusto, Federica; Geginat, Jens; Lanzavecchia, Antonio (Apr 2004). «Central Memory and Effector Memory T Cell Subsets: Function, Generation, and Maintenance». Annual Review of Immunology 22 (1): 745-763. doi:10.1146/annurev.immunol.22.012703.104702.
Bibliografía
Walport, Ken Murphy, Paul Travers, Mark (2011). Janeway's Immunobiology (8. ed. edición). Oxford: Taylor & Francis. ISBN 9780815342434. Archivado desde el original el 20 de octubre de 2014. Consultado el 17 de octubre de 2015.
Abbas, Abul K.; Lichtman, Andrew H.; Shiv, Pillai (2014). Cellular and molecular immunology (8th edition edición). Elsevier. ISBN 9780323222754.