Symétrie moléculaire
En chimie, la symétrie moléculaire décrit la symétrie présente dans les molécules ainsi que la classification de ces molécules en fonctions de leur symétrie. La symétrie moléculaire est un concept fondamental en chimie car elle permet de prévoir ou d'expliquer un grand nombre des propriétés chimiques des molécules telles que les transitions spectroscopiques permises ou encore la présence ou l'absence d'un moment dipolaire. Elle repose sur la théorie des groupes et implique de définir les états des molécules à l'aide de représentations irréductibles des groupes à partir de la table des caractères du groupe de symétrie de la molécule. La symétrie est utile pour étudier les orbitales moléculaires en application de la méthode de Hückel, de la théorie du champ de ligands et des règles de Woodward–Hoffmann. Elle est également utilisée en cristallographie à travers les systèmes cristallins pour décrire les symétries dans les matériaux massifs. La chimie de coordination, l'étude des orbitales moléculaires et la spectroscopie des espèces chimiques utilisent la notation Schoenflies pour décrire à quel groupe ponctuel de symétrie se rattache une molécule ; en cristallographie, on utilise plutôt les symboles de Hermann-Mauguin.
Il existe de nombreuses techniques permettant de déterminer la symétrie d'une molécule donnée, comme la cristallographie aux rayons X et diverses formes de spectroscopie. Les notations spectroscopiques reposent sur des considérations de symétrie.
Opérations de symétrie et éléments de symétrie
Les opérations de symétries peuvent être représentées de plusieurs manières. On peut le faire par exemple à l'aide de matrices dont les colonnes représentent, pour une base donnée, les coordonnées des nouveaux vecteurs obtenus après transformation des vecteurs de la base par l'opération de symétrie. On appelle caractère de la représentation la trace de cette matrice. Les représentations irréductibles du groupe sont souvent utilisées, car toutes les autres représentations du groupe peuvent être décrites comme des sommes directes de représentations irréductibles (théorème de Maschke).
Une opération de symétrie est une transformation géométrique qui échange des atomes équivalents ou laisse les atomes invariants[1]. Pour chaque groupe ponctuel, une table des caractères résume l'information sur les opérations de symétrie du groupe et ses représentations irréductibles. On peut ainsi établir une liste de tables de caractères utiles en chimie (en). Dans ces tables, chaque ligne correspond à une représentation irréductible (désignée par une étiquette de symétrie), chaque colonne à une opération de symétrie (désignée par sa notation Schoenflies), et les deux dernières colonnes indiquent quels sont les vecteurs usuels, notamment les orbitales atomiques, qui suivent les transformations indiquées par chaque représentation irréductible.
En effet, si toutes les opérations de symétrie du groupe auquel se rattache la molécule laissent celle-ci inchangée, une opération du groupe ne laisse pas forcément inchangé chacun des vecteurs considérés. Les vecteurs que l'on considère sont souvent des orbitales atomiques ou des vecteurs d'espace dont la variation décrit une vibration moléculaire. C'est pourquoi on attache à chacune de ces orbitales ou chacun de ces vecteurs une étiquette de symétrie qui correspond à « sa » représentation irréductible dans le groupe de la molécule, c'est-à-dire à la représentation irréductible du groupe qui décrit les transformations du vecteur considéré. Ainsi, dire que deux orbitales moléculaires sont « de même symétrie » signifie qu'elles ont la même représentation irréductible. Ce vocabulaire est notamment utilisé en spectroscopie où les transitions entre deux niveaux d'énergie seront considérées comme « permises de symétrie » si elles se font entre deux orbitales de même symétrie, au sens indiqué ici.
Il existe cinq familles d'opérations de symétrie qui peuvent laisser la géométrie d'une molécule inchangée : les rotations, les réflexions, les inversions, les rotations impropres et l'élément identité. Chaque opération de symétrie est associée à un élément de symétrie tel qu'un axe, un plan, ou un centre : par exemple, une rotation se fait autour d'un axe de symétrie, et une réflexion se fait par rapport à un plan de symétrie.
Rotations

Si la rotation d'une molécule par 360°n autour d'un axe donné redonne une molécule identique à la molécule initiale, l'axe en question est dit un axe de rotation d'ordre n, désigné par le symbole Cn. Par exemple, dans le cas du trifluorure de bore BF3, l'axe perpendiculaire au plan moléculaire est un axe C3. Cet axe génère trois opérations de rotation : C3, C32 et C33 = E (l'élément identité, voir plus loin).
Si une molécule possède plus d'un axe de rotation, l'axe d'ordre le plus grand est dit axe principal. Dans le cas du trifluorure de bore, l'axe C3 est l'axe principal de rotation. Il existe également trois axes C2 équivalents, un sur chaque liaison B–F, car la rotation par 180⁰ autour d'une liaison passant par un atome de fluor ne fait qu'échanger les deux autres atomes de fluor.
Dans une molécule linéaire comme HCl ou HC≡CH, l'axe moléculaire est un axe d'ordre infini C∞, parce qu'il existe un nombre infini d'angles de rotation qui redonnent une molécule identique à la molécule initiale.

Réflexions
La réflexion d'une molécule dans un plan est dite opération de symétrie lorsqu'elle génère une copie identique à la molécule initiale. Dans ce cas le plan de réflexion est l'élément de symétrie dit plan de symétrie ou plan miroir, et désigné par le symbole σ (sigma = « s » grec, du mot allemand Spiegel = « miroir »).
La molécule de formaldéhyde HCHO possède deux plans miroirs dits verticaux (symbole v) parce qu'ils contiennent l'axe de rotation C2 de la molécule. Le plan désigné σv passe entre les deux atomes d'hydrogène, et la réflexion dans ce plan échange les deux atomes d'hydrogène l'un pour l'autre. Le plan désigné σv’ contient les deux atomes d'hydrogène, qui ne sont pas alors déplacés par la réflexion dans ce plan. Si une molécule contient plus d'un axe de rotation, un plan dit vertical contient l'axe principal.
D'autres molécules présentent un plan horizontal (σh) perpendiculaire à l'axe principal. Pour la molécule BF3, par exemple, le plan de la molécule est σh parce qu'il est perpendiculaire à l'axe C3.
Centre d'inversion

Une molécule possède un centre d'inversion (abrégé i ) ou centre de symétrie si pour chaque atome dans la molécule hors le centre même, il existe un autre atome identique directement à travers du centre et à distance égale du centre. En effet, si le centre de symétrie est à l'origine des coordonnées, les atomes identiques se trouvent aux points (x, y, z) et (−x, −y, −z). L'opération d'inversion a pour effet de déplacer chaque atome jusqu'à l'atome identique à l'autre côté du centre.
Le centre même peut être occupé par un atome ou non. Par exemple, l'hexafluorure de soufre SF6 présente une géométrie octaédrique et son centre d'inversion se trouve au niveau de l'atome de soufre, tandis que le benzène C6H6 présente une géométrie plane hexagonale et son centre d'inversion est au centre du cycle où ne se trouve aucun atome.
Rotations impropres

Dans certaines molécules, la combinaison (dite produit) d'une rotation Cn et de la réflexion dans un plan perpendiculaire à cet axe peut être une opération de symétrie, même si la rotation seule ou la réflexion seule ne sont pas des opérations de symétrie. Dans ce cas, l'opération de symétrie est dite rotation-réflexion ou bien rotation impropre (symbole Sn).
À titre d'exemple, la liaison carbone-carbone de l'éthane n'est pas axe de symétrie C6 bien qu'il soit un axe C3, et le plan σh perpendiculaire à cette liaison en son centre n'est pas non plus un plan de symétrie. Cependant, le produit S6 = σhC6 (ou bien C6σh) est bien une opération de symétrie, parce qu'il amène chaque atome dans un atome équivalent. L'axe S6 génère les opérations S6, S62 = C3, S63 = S2 = i, S64 = C32 , S65 et S66 = E.
Un axe S1 correspond à un plan de réflexion (sans rotation), et un axe S2 correspond à un centre d'inversion. Une molécule tétraédrique telle que le méthane possède trois axes S4.
Identité
L'élément neutre du groupe, ou élément identité, est noté E, du mot allemand Einheit qui signifie « unité ». Toute molécule possède cet élément, qui ne fait aucun changement à la molécule. Bien que cet élément semble trivial, il convient de l'inclure dans l'ensemble des éléments de symétrie pour former un groupe mathématique, dont la définition exige l'inclusion de l'élément identité. En effet, il est analogue à l'opération mathématique de « multiplier par 1 », qui ne change pas le nombre sur lequel elle agit.
Les groupes de symétrie
Les groupes en mathématiques
Les opérations de symétrie d'une molécule (ou d'un autre objet) forment un groupe. En mathématiques, un groupe est un ensemble pourvu d'une opération binaire qui satisfait les quatre propriétés de groupe ci-dessous. Dans un groupe de symétrie, les éléments du groupe sont les opérations de symétrie (et non les éléments de symétrie), et la combinaison binaire (ou produit) de deux éléments a pour effet d'appliquer successivement une opération de symétrie puis l'autre. Par exemple, la composition d'une rotation C4 autour de l'axe z suivie d'une réflexion par rapport au plan xy est désignée par σ(xy) C4. Par convention, l'ordre des opérations est représenté de droite à gauche.
Un groupe de symétrie obéit aux quatre propriétés ci-dessous, qui définissent tous les groupes :
- Propriété de fermeture. Pour chaque paire d'éléments x et y du groupe G, le produit x y est aussi élément du groupe G. Ceci implique que le groupe est fermé de sorte que combiner deux éléments ne produit aucun nouvel élément. Les opérations de symétrie ont toutes cette propriété parce que la suite de deux opérations doit produire un troisième état impossible à distinguer du deuxième état et donc du premier état, de sorte que l'effet net sur la molécule est toujours une opération de symétrie.
- Associativité. Pour chaque x et y et z du groupe G, les deux combinaisons triples (x y) z et x (y z) donnent un même élément de G. C'est-à-dire (x y) z = x (y z) pour tout x, y, et z ∈ G.
- Existence d'un élément neutre. Tout groupe G doit avoir un élément neutre (ou élément identité) E de sorte que les produits de E avec un élément quelconque x de G laisse l'élément inchangé : x E = E x = x. Pour un groupe de symétrie moléculaire, l'élément neutre a pour effet de laisser tout atome en position inchangée.
- Existence d'un inverse de chaque élément. Pour chaque élément x de G, il existe un élément inverse y tel que x y = y x = E. Par exemple, l'inverse d'une rotation dans un sens donné est une rotation de même angle mais de sens opposé.
L'ordre d'un groupe est le nombre d'éléments qu'il contient.
Groupes ponctuels de symétrie

L'application consécutive (dite composition) de deux ou plusieurs opérations de symétrie d'une molécule correspond à une seule opération de symétrie. Par exemple, une rotation C2 suivie d'une réflexion σv équivaut à la réflexion σv’. Ceci s'écrit σv*C2 = σv’, où par convention l'opération qui est effectuée en premier est écrite à droite. L'ensemble de toutes les opérations de symétrie de la molécule (y compris les compositions) obéit à toutes les propriétés d'un groupe.
Ce groupe forme le groupe ponctuel de symétrie de la molécule. Le mot ponctuel implique que l'ensemble des opérations de symétrie laisse au moins un point fixe dans l'espace. Pour certaines opérations, un axe entier ou un plan entier reste fixe. Le groupe ponctuel inclut toutes les opérations qui laissent ce point fixe. En revanche, la symétrie d'un cristal est décrite par un groupe d'espace qui inclut également des opérations de translation dans l'espace.
Exemples des groupes ponctuels de symétrie
L'attribution d'un groupe ponctuel à chaque molécule classe les molécules en catégories avec des propriétés semblables de symétrie. Par exemple, les molécules PCl3, POF3, XeO3, et NH3 partagent toutes le même ensemble de six opérations de symétrie[2]. On peut leur appliquer l'élément neutre E, deux rotations C3 différentes, et trois réflexions σv différentes sans changer leurs géométries, de sorte qu'elles ont toutes le même groupe ponctuel d'ordre 6 nommé C3v[3].
De même, l'eau H2O et le sulfure d'hydrogène H2S partagent également des opérations de symétrie identiques. On peut leur appliquer l'élément neutre E, une rotation C2 et deux réflexions σv et σv’. Cet ensemble correspond au groupe ponctuel C2v d'ordre 4[4].
L'organigramme ci-contre permet d'identifier le groupe ponctuel de symétrie de la grande majorité de molécules. Ce système de classement aide les scientifiques à étudier les molécules de façon plus efficace, parce que les molécules de nature chimique semblable et de même groupe de symétrie ont généralement des liaisons et des propriétés spectroscopiques semblables[3].
Tableau de groupes ponctuels
Ce tableau fournit une liste de groupes ponctuels communs nommés selon la notation Schoenflies employés en chimie et en spectroscopie moléculaire. Les structures indiquées incluent les formes communes des molécules, qui peuvent souvent être expliquées par la théorie VSEPR.
| Groupe ponctuel | Opérations de symétrie[5] | Description simple de la géométrie type | Exemple 1 | Exemple 2 | Exemple 3 |
| C1 | E | aucune symétrie, chirale |  Bromochlorofluorométhane (deux énantiomères indiqués) |
 Acide lysergique |
 L-Leucine et la plupart des autres acides α-aminés hormis la glycine |
| Cs | E σh | plan miroir, aucune autre symétrie |  Chlorure de thionyle, SOCl2 |
 Acide hypochloreux, HClO |
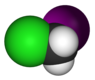 Chloroiodométhane, CH2ClI |
| Ci | E i | centre d'inversion |  Acide mésotartrique |
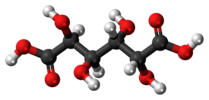 Acide mucique (acide méso-galactarique) |
(S,R) 1,2-Dibromo-1,2-dichloroéthane (conformère anti) |
| C∞v | E 2C∞Φ ∞σv | linéaire |  Fluorure d'hydrogène, HF (et toute autre molécule diatomique hétéronucléaire) |
 Protoxyde d'azote, N2O |
 Cyanure d'hydrogène, HCN |
| D∞h | E 2C∞Φ ∞σi i 2S∞Φ ∞C2 | linéaire avec centre d'inversion |  Dioxygène, O2 (et toute autre molécule diatomique homonucléaire) |
 Dioxyde de carbone, CO2 |
 Acétylène, HC≡CH |
| C2 | E C2 | "géométrie à livre ouvert", chirale |  Peroxyde d'hydrogène, H2O2 |
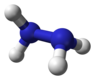 Hydrazine, N2H4 |
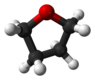 Tétrahydrofurane (conformation tordue) |
| C3 | E C3 | hélice aérienne, chirale |  Triphénylphosphine |
 Triéthylamine |
 Acide phosphorique |
| C2h | E C2 i σh | plane avec centre d'inversion, aucun plan vertical |  trans-1,2-Dichloroéthène |
 trans-Difluorure de diazote |
 trans-Azobenzène |
| C3h | E C3 C32 σh S3 S35 | hélice aérienne |  Acide borique |
 Phloroglucinol (1,3,5-trihydroxybenzène) |
|
| C2v | E C2 σv(xz) σv’(yz) | coudée (angulaire) (H2O) ou balançoire de bascule (SF4) ou forme en T (ClF3) |  Eau |
 Tétrafluorure de soufre |
 Trifluorure de chlore |
| C3v | E 2C3 3σv | pyramide trigonale | 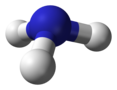 Ammoniac |
 Trichlorure de phosphoryle, POCl3 |
 Hydrocarbonyle de cobalt, HCo(CO)4 |
| C4v | E 2C4 C2 2σv 2σd | pyramidale à base carrée |  Oxytétrafluorure de xénon |
 Pentaborane(9), B5H9 |
 Anion nitroprussiate [Fe(CN)5(NO)]2− |
| C5v | E 2C5 2C52 5σv | tabouret |  (η5-C5H5)Ni(NO) |
 Corannulène |
|
| D2 | E C2(x) C2(y) C2(z) | tordue, chirale |  Biphényle (conformère gauche) |
 Twistane (C10H16) |
 Forme bateau croisée du cyclohexane |
| D3 | E C3(z) 3C2 | hélice triple, chirale |  Cation tris(éthylènediamine)cobalt(III) |
 Anion ferrioxalate |
|
| D2h | E C2(z) C2(y) C2(x) i σ(xy) σ(xz) σ(yz) | plane avec centre d'inversion et plans verticaux |  Éthylène |
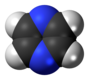 Pyrazine |
 Diborane |
| D3h | E 2C3 3C2 σh 2S3 3σv | plane trigonale |  Trifluorure de bore |
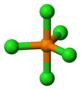 Pentachlorure de phosphore |
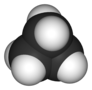 Cyclopropane |
| D4h | E 2C4 C2 2C2’ 2C2’’ i 2S4 σh 2σv 2σd | plane carrée |  Tétrafluorure de xénon |
 Anion octachlorodimolybdate(II) |
 trans-[CoIII(NH3)4Cl2]+ (atomes H exclus) |
| D5h | E 2C5 2C52 5C2 σh 2S5 2S53 5σv | pentagonale |  Anion cyclopentadiényle, C5H5− |
 Ruthénocène |
 Fullerène C70 |
| D6h | E 2C6 2C3 C2 3C2’ 3C2’’ i 2S3 2S6 σh 3σd 3σv | hexagonale |  Benzène |
 Bis(benzène)chrome |
 Coronène, C24H12 |
| D7h | E C7 S7 7C2 σh 7σv | heptagonale |  Ion tropylium, C7H7+ |
||
| D8h | E C8 C4 C2 S8 i 8C2 σh 4σv 4σd | octagonale |  Anion cyclooctatétraénure, C8H82− |
 Uranocène |
|
| D2d | E 2S4 C2 2C2’ 2σd | tordue à 90° |  Allène |
 Tétranitrure de tétrasoufre |
 Diborane(4) (état excité) |
| D3d | E 2C3 3C2 i 2S6 3σd | tordue à 60° |  Éthane (conformation décalée) |
 Octacarbonyle de dicobalt (isomère sans pont) |
 Cyclohexane en conformation chaise |
| D4d | E 2S8 2C4 2S83 C2 4C2’ 4σd | tordue à 45° |  Cyclooctasoufre, S8 |
 Décacarbonyle de dimanganèse (rotamère décalé) |
 Ion octafluoroxénate (géométrie idéale) |
| D5d | E 2C5 2C52 5C2 i 2S103 2S10 5σd | tordue à 36° |  Ferrocène (rotamère décalé) |
||
| S4 | E 2S4 C2 |  1,2,3,4-Tétrafluorospiropentane[6] |
|||
| Td | E 8C3 3C2 6S4 6σd | tétraèdre |  Méthane |
 Pentoxyde de phosphore |
 Adamantane |
| Oh | E 8C3 6C2 6C4 3C2 i 6S4 8S6 3σh 6σd | octaédrique ou cubique |  Hexafluorure de soufre |
 Hexacarbonyle de molybdène |
 Cubane |
| Ih | E 12C5 12C52 20C3 15C2 i 12S10 12S103 20S6 15σ | icosaédrique ou dodécaédrique |  Buckminsterfullerène, C60 |
 Anion dodécaborate |
 Dodécaédrane |
Notes et références
- Alain Sevin et al., Chimie Générale - tout le cours en fiches, Dunod, , p. 16-17
- Brian Pfennig, Principles of Inorganic Chemistry, Wiley, 191 p. (ISBN 978-1-118-85910-0)
- Brian Pfennig, Principles of Inorganic Chemistry, Wiley (ISBN 978-1-118-85910-0)
- Gary Miessler, Inorganic Chemistry, Pearson, (ISBN 9780321811059, lire en ligne
 )
)
- Gary L. Miessler, Inorganic Chemistry, Prentice-Hall, , 2e éd. (ISBN 0-13-841891-8), p. 621-630
- (en) C. E. Housecroft et A. G. Sharpe, Inorganic Chemistry, 3e éd., Prentice Hall, 2008, p. 111-112. (ISBN 978-0-13-175553-6)