Sindrome da prolasso valvolare mitralico
| Sindrome da prolasso valvolare mitralico | |
|---|---|
 | |
| Specialità | cardiologia |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 394.0 e 424.0 |
| OMIM | 157700, 607829 e 610840 |
| MeSH | D008945 |
| MedlinePlus | 000180 |
| eMedicine | 759004 e 155494 |
| Sinonimi | |
| sindrome di Barlow sindrome del click sistolico sindrome del soffio telesistolico sindrome della valvola mitralica mixomatosa | |
La sindrome da prolasso valvolare mitralico, chiamata anche sindrome di Barlow o sindrome del click sistolico o sindrome del soffio telesistolico[1], è una valvulopatia caratterizzata dallo spostamento di una cuspide, anormalmente ispessita, della valvola mitrale nell'atrio sinistro durante la sistole[2].
Nel 1963 il cardiologo John Brereton Barlow e i suoi collaboratori[3] confermarono, mediante cineangiografia, come certi casi con il click e il soffio fossero dovuti a insufficienza valvolare mitralica[1]. La locuzione «sindrome da prolasso valvolare mitralico» fu coniata da J. Michael Criley nel 1966[4], per poi essere ripresa da altri autori[5][6].
È presente nel 5-10% della popolazione mondiale, generalmente con precisi sintomi ma con basso rischio di complicanze[7]. La sua eziologia può essere di natura degenerativa e abbraccia un ampio spettro di alterazioni infiltrative o displasiche del tessuto mitralico come la fibroelastosi endocardica e la sindrome di Marfan[8].
Il reperto più comune è il prolasso (ovvero la fuoriuscita di un viscere dalla cavità in cui è contenuto, attraverso un'apertura naturale: in questo caso si tratta di un lembo della valvola, che protrude dal ventricolo nell'atrio sinistro) di uno o più segmenti dovuti ad allungamento e/o rottura delle corde tendinee, o a ridotta coaptazione dei lembi da disfunzione anatomo-funzionale dell'apparato mitralico, situazioni che possono portare a insufficienza della valvola[9]. Nei casi più gravi può esitare in insufficienza mitralica severa, o complicarsi con una endocardite[10], o condurre sino all'arresto cardiaco[11], se si innescano aritmie ventricolari maligne[7].
Epidemiologia e storia
Nel 1963, John Brereton Barlow descrisse le caratteristiche auscultatorie di
Il termine "prolasso della valvola mitrale" è stato coniato dal dott. John Michael Criley nel mese di aprile del 1964 e riscosse tanto successo da essere accettato dalla maggior parte dei cardiologi, rispetto ad altri termini utilizzati per la stessa malattia[5].
Per molti anni la conoscenza di questa malattia fu scarsa e venne associata a una varietà di segni e sintomi, senza alcuna connessione logica, tra cui dispnea, astenia, angina pectoris e la politelia (più capezzoli)[7]. La modifica dei criteri per la diagnosi di prolasso della valvola mitrale con l'utilizzo dell'ecocardiografia ha condotto a un eccesso di inserimento di pazienti in studi epidemiologici e di prevalenza[12]. Studi più recenti, dal 1998 al 2002, confermano che la sovra-diagnosi di prolasso della mitrale dipendeva da metodi diagnostici obsoleti e meno affidabili, come e soprattutto l'ecocardiografia M-mode. Dal 1980 con l'avvento dell'ecocardiografia bidimensionale prima e della tridimensionale dopo, si sono potuti riclassificare diversi sottotipi in relazione ai nuovi criteri[13].
Fra il 1980 e il 1990 si pensava che tale sindrome colpisse il 5-15% dell'intera popolazione,[14] mentre oggi, dopo la definizione di precisi criteri ecocardiografici di diagnosi[7], l'incidenza è stata stimata del 3-5% a livello mondiale (negli Stati Uniti d'America è presente nello 0,6-2,4% della popolazione, essendo più comune della valvola aortica bicuspide[1]), anche se il prolasso rimane una delle malattie più diffuse fra le anomalie valvolari. Colpisce entrambi i sessi e non si distinguono differenze in base all'età[12]. Alcuni dati statunitensi, basati sulla prevalenza del prolasso nelle autopsie, darebbero una stima di prevalenza nella popolazione di circa il 7-10%[7].
Eziologia
L'apparato valvolare mitralico è una struttura anatomicamente complessa costituita dall'anulus, dai lembi valvolari, dalle corde tendinee, dai muscoli papillari e dalle pareti del ventricolo, dell'atrio e della radice aortica[1]. Le cause più frequenti che comportano alterazioni dell'apparato valvolare fanno riferimento a cause di tipo degenerativo e infiltrative del tessuto mitralico come la fibroelastosi, il morbo di Barlow, la sindrome di Ehlers-Danlos, la sindrome di Marfan e l'osteogenesi imperfetta[1]. Ciò nonostante vengono riconosciute diverse altre patologie che hanno in comune la modifica anatomica patognomonica della sindrome[1].
Il prolasso valvolare primario talora è associato a una forma famigliare con trasmissione autosomica dominante a penetranza variabile[1]. Alterazioni di tipo genetico correlate al cromosoma 11, 16 e cromosoma 15, sono state associate in special modo al prolasso della valvola con caratteristiche mixomatose[15]; del cromosoma 15 è coinvolto il gene FBN1: fibrillina 1 (legata alla sindrome di Marfan)[8]. L'anoressia nervosa è stata associata molto spesso al prolasso, probabilmente correlato alla diminuzione dei diametri cardiaci tipici di questa patologia[16][17].
Altri autori ritengono che il prolasso possa risultare da un'embriogenesi difettosa della linea cellulare di origine mesenchimale, così si spiegherebbe l'associazione della valvulopatia con un'aumentata incidenza di malattia di Von Willebrand e di altre coagulopatie[8].
Qualora il prolasso della valvola fosse l'unica patologia riscontrata nel paziente, la trasformazione mixomatosa delle cuspidi in sostituzione del tessuto connettivo è la causa principale dello sviluppo del prolasso.[6]
Sono state identificate altre cause come nel caso della sindrome dell'X fragile, della sindrome di Marfan[18], della febbre reumatica, dell'endocardite, della scoliosi e non meno dell'età avanzata che può determinare una calcificazione distrofica dell'anulus con conseguente alterazione della mobilità dei lembi valvolari[19].
Patogenesi e anatomia patologica

LA: atrio sinistro; LV: ventricolo sinistro.
La valvola mitrale è una delle valvole atrioventricolari del cuore, la cui funzione è quella di permettere il passaggio del sangue dall'atrio al ventricolo durante la diastole e di impedirne la risalita dal ventricolo sinistro in atrio sinistro durante la sistole.[20]
Le valvole atrioventricolari comprendono:
- formazioni fibrose che costituiscono l'anello valvolare;
- i lembi valvolari o cuspidi;
- le corde tendinee con i muscoli papillari.[20]
La valvola mitrale presenta due cuspidi: una, più grande, posta in avanti e medialmente, che corrisponde alla parete anteriore e sinistra del setto, guarda l'orifizio aortico e si chiama cuspide anteriore o aortica; l'altra, più piccola, posta indietro e lateralmente, che corrisponde alla parete posteriore del ventricolo sinistro e si chiama cuspide posteriore[21][22]. I lembi sono composti da tessuto connettivo, ricco di fibre elastiche e collagene. I due punti in cui i lembi valvolari si uniscono tra loro e all'anulus valvolare sono detti commissure: quest'area può essere identificata mediante l'asse dei corrispondenti muscoli papillari e le corde tendinee commissurali. L'apertura della valvola è circondata, come detto, da un anello fibroso: struttura circonferenziale di tessuto connettivo che delimita l'orifizio della valvola[21][23].
Nei pazienti con prolasso della valvola mitrale, nella sua forma classica, si ha un accumulo di proteoglicani e un eccesso di tessuto connettivo che tende a separare le fibre di collagene dello strato fibroso[24]. Ciò è dovuto a un accumulo di dermatan solfato, di glicosaminoglicani o mucopolisaccaridi acidi e non infiltrati infiammatori; l'eccesso di dermatan solfato caratterizza l'ispessimento dei lembi nella degenerazione mixomatosa dei tessuti causando ridondanza, aumento di volume e insufficienza funzionale della cuspide interessata[25].
Come conseguenza, l'intero apparato valvolare si indebolisce, provocando frequentemente l'allungamento e la rottura delle corde tendinee, specie del lembo posteriore. Questo può divenire un processo cronico, soprattutto nelle donne oltre i 60 anni, e predispone alla calcificazione dell'anello con ipertrofia e insufficienza mitralica[26].
Altre lesioni più avanzate, spesso interessanti il lembo posteriore, portano a un ispessimento notevole con prolasso severo in atrio sinistro.
Complicanze
Nella storia della sindrome e sino ai primi anni 1980, si sono proposte delle associazioni tra il prolasso mitralico e una serie di gravi complicanze quali la morte improvvisa e le aritmie cardiache complesse[27], l'embolia polmonare e cerebrale, l'endocardite, l'insufficienza mitralica severa con scompenso cardiaco[28]. In realtà i singoli casi o le casistiche molto limitate hanno condotto a importanti bias di selezione, per cui spesso il quadro clinico del prolasso mitralico portava a valutazioni non sempre corrette[29].
Dal 1986 in poi il numero dei pazienti arruolati e il loro follow-up sono cresciuti esponenzialmente e ciò ha permesso di chiarire quali sono i parametri che possono rivestire un significato prognostico in tale valvulopatia: in particolare, essendo una patologia ereditaria[30][31], è possibile ottenere informazioni sul rischio clinico di complicanze in modo corretto, in quanto libere dai bias di selezione[32], potendo valutare i parenti, cioè soggetti non selezionati[33] e riscontrando che in casi asintomatici, il rischio di complicanze è all'incirca un quarto rispetto ai soggetti sintomatici.
È stato tracciato un profilo di rischio clinico, che identifica almeno tre sottogruppi[33]:
- sottogruppo ad alto rischio, con incidenza annuale di complicanze di circa il 5%; costituito da pazienti che presentano un'insufficienza mitralica severa;
- sottogruppo a rischio intermedio, tra l'1 e il 2% per anno, costituito da soggetti di sesso maschile;
- sottogruppo a basso rischio, < 0,5% per anno, che comprende donne giovani.
L'incidenza di complicanze viene riportata in percentuali variabili dallo 0,3 al 3,7 per 100 pazienti/anno[34][35][36] questo perché le differenti storie naturali esprimono differenti caratteristiche nelle popolazioni osservate[37].
Le complicanze più frequenti sono riportate di seguito:
- rigurgito mitralico: il prolasso è spesso, ma non sempre, accompagnato all'insufficienza valvolare. Le situazioni più gravi sono associate a rigurgiti severi da rottura delle corde tendinee di tipo ischemico e/o degenerativo (sindrome di Marfan)[34], negli altri casi l'insufficienza non è tale da creare problemi emodinamici;
- tromboembolia: non sono molto frequenti, ma furono descritte embolie retiniche in un numero limitato di pazienti[38][39][40], mentre l'ictus embolico è presente in una quota maggiore (sino al 25% dei pazienti affetti da insufficienza valvolare)[41], se accompagnate a comorbidità[42];
- aritmie cardiache: la sintomatologia più frequentemente riferita dai portatori di prolasso è la palpitazione: diversi studi su vaste popolazioni hanno evidenziato una correlazione fra aritmie e presenza di insufficienza mitralica, ma in numero minore se in assenza di tal segno[43]:
- aritmie atriali: fibrillazione atriale e flutter atriale sono fra le aritmie più frequenti[44], spesso correlate all'età del paziente. Raramente si sono evidenziati disturbi della conduzione cardiaca[45];
- aritmie ventricolari: sono maggiormente presenti nei pazienti con prolasso valvolare associato a rigurgito mitralico, la quota varia dal 40 al 90%, rispetto alla popolazione di controllo[41]. Si tratta spesso di battiti prematuri (extrasistoli) frequenti, ripetitivi e di tachicardie ventricolari non sostenute[7]. Alcuni studi hanno mostrato una certa correlazione fra morte improvvisa e prolasso valvolare mitralico complicato da severa insufficienza valvolare[46], specie se associato a dei lembi mixomatosi.
Clinica
Classificazione

LV: ventricolo sinistro; LA: atrio sinistro; RV: ventricolo destro; RA: atrio destro.
Il prolasso valvolare mitralico può essere classificato in primitivo (con alterazioni dell'apparato valvolare) e in funzionale (con apparato valvolare normale). In realtà vi sono almeno tre classificazioni, di tre autori diversi:
- Carpentier nel 1980[9], ne propose una che si basava sulla motilità dei lembi (classificazione chirurgica): tipo I, normale; tipo II, eccessivo; tipo III, restrittivo;
- Barlow nel 1985[47] riportò differenti quadri anatomici: billowing, semplice rigonfiamento e protrusione dei lembi in atrio; prolapse, protrusione sistolica dei lembi valvolari con mancata coaptazione dei bordi e conseguente rigurgito; floppy valve, estrema protrusione di voluminose cuspidi mitraliche associata ad anomalie delle corde tendinee; flail valve, mitrale disancorata in un punto qualsiasi dell'anulus, per rottura di corde tendinee;
- Devereux nel 1987[48] propose la seguente:
Attualmente la classificazione più accettata e corretta è l'ultima di Devereux, poiché nella sua definizione non inserisce la coaptazione dei lembi e quindi non considera scontata l'insufficienza della valvola, spesso non presente. In effetti il rigurgito va considerato più una complicanza, che un reperto sempre presente[7].
Segni e sintomi
L'auscultazione cardiaca permette di individuare in modo semplice e veloce i pazienti affetti da rigurgito mitralico: il segno clinico principale consiste in un click non-espulsivo localizzato in meso-telesistole, dovuto al rapido tendersi delle corde tendinee allungate o al lembo prolassante che raggiunge la sua massima escursione. A volte è seguito da un soffio mesotelesistolico in crescendo-decrescendo[50].
Importante ai fini diagnostici è la variazione del click rispetto al primo tono cardiaco e della durata del soffio cardiaco in rapporto ad alcune specifiche manovre: tutte le manovre che riducono il volume ventricolare sinistro (ortostatismo, manovra di Valsalva) rendono il click precoce e il soffio più lungo, mentre tutte le manovre che aumentano il volume ventricolare sinistro (accovacciamento, esercizio isometrico intenso) ritardano il click e accorciano il soffio[51].
Per ragioni non note, i pazienti con prolasso della mitrale tendono ad avere un indice di massa corporea basso e sono più esili. Spesso presente in portatori di sindrome di Ehlers-Danlos, distrofia miotonica di Steinert e sindrome di Marfan, raggiungendo, in quest'ultima sindrome, circa il 90% dei riscontri[51].
Tra i sintomi, piuttosto variabili, possono essere presenti dolori precordiali atipici[52], astenia, tachicardia[53] (a volte riferibili ad aritmie) e dispnea. In casi rari sincopi[54].
Esami di laboratorio e strumentali
Gli esami più comunemente usati per una corretta diagnosi sono i seguenti:
- elettrocardiogramma: in genere è normale. In alcuni casi si possono individuare delle onde T invertite[55][56], alterazioni del tratto ST[56][57], o prolungamento del QT talora presenti nelle derivazioni inferiori (DII, DIII, aVF)[50][58]. Tali alterazioni sono più frequenti durante esercizio fisico[59];
- ecocardiografia mono- e bidimensionale, è l'esame che può valutare la valvola mitrale in modo diretto e che fornisce informazioni morfologiche sui lembi e sulla loro dinamica di chiusura. Le sezioni ecocardiografiche generalmente utilizzate per la diagnosi di prolasso valvolare mitralico sono l'asse lungo parasternale e le tre camere apicali[56]. In effetti, per la conformazione a sella della valvola, non dovrebbe essere utilizzata la sezione 4 camere apicale, anche se spesso viene valutata comunque[13]. Vengono analizzati i seguenti parametri[7]:
- la mobilità dei lembi (normale, eccessiva o ridotta);
- l'apposizione, ovvero la modalità con cui i margini si affrontano;
- la coaptazione, ovvero la modalità di contatto tra i margini dei lembi;
- infine, deve essere misurato il diametro dell'anello mitralico, che deve essere rapportato alla lunghezza del lembo anteriore in diastole.
- ecocardiografia transesofagea e la più recente tridimensionale, permettono una valutazione più accurata della valvola, dell'entità e della meccanica dell'eventuale rigurgito associato[60]. In particolare l'eco tridimensionale è particolarmente utile nelle patologie a trattamento chirurgico per la tipologia di immagine che può essere ricostruita[61][62].
Esami meno frequenti, ma talora utilizzati per diagnosi differenziali possono contemplare la radiografia del torace, la scintigrafia miocardica, il cateterismo cardiaco e lo studio elettrofisiologico[63].

Trattamento
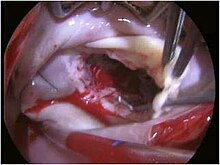


La maggior parte dei prolassi della valvola mitrale sono asintomatici e difficilmente arriveranno alla terapia chirurgica. In realtà una certa percentuale di pazienti, se è presente il rigurgito valvolare e questo sia moderato, andrà incontro a delle valutazioni cliniche seriate per seguire l'andamento delle alterazioni anatomiche nel tempo e poter definire il timing chirurgico con maggior precisione[64].
Si possono distinguere almeno tre fasi nel follow-up di tali pazienti:
- nella prima fase, se è presente solo un piccolo rigonfiamento (billowing) evidenziabile solo all'ecocardiogramma e privo di rumori aggiunti all'auscultazione, non si deve considerare alcuna terapia, né di tipo medico, né di tipo chirurgico;
- nella seconda fase, qualora comparisse un'insufficienza valvolare da prolasso vero e proprio, entreranno in gioco diversi parametri, i più importanti dei quali sono: il grado di insufficienza e l'influenza di questa sui vasi polmonari a monte che scaricano il sangue in atrio sinistro, il grado di dilatazione dell'atrio e le dimensioni del ventricolo sinistro[65];
- nella terza fase, qualora il rigurgito fosse severo o vi fosse un flail mitralico da rottura di corde tendinee, si dovrà ricorrere all'intervento in breve tempo.
Non necessariamente un paziente attraversa tutte e tre le fasi, in genere il problema si pone in presenza di rigurgito, che può provocare nel tempo importanti alterazioni anatomiche. Le tecniche attualmente si orientano sulla terapia chirurgica mini invasiva[66][67][68] e sulla ricostruzione della valvola piuttosto che l'impianto di protesi valvolare cardiaca[69][70][71].
Nelle riparazioni della mitrale con severo prolasso da degenerazione mixomatosa e no, vengono sempre più spesso utilizzate le corde tendinee artificiali, che hanno confermato degli eccellenti risultati a breve e medio termine[72][73].
Da qualche anno la riparazione robotica viene utilizzata in pazienti con problemi alla correzione chirurgica tradizionale[74].
Sono in corso studi di confronto fra l'anuloplastica mitralica con anello sottodimensionato verso la sostituzione protesica, per l'insufficienza mitralica severa da ischemia miocardica[75].
Prognosi
Solitamente, il prolasso della valvola mitrale è una patologia con prognosi benigna. Tuttavia, in alcuni registri la mortalità complessiva è del 15-20% superiore rispetto alla media della popolazione generale[76].
Ciò che meglio correla con la mortalità sono la gravità del rigurgito mitralico e la ridotta frazione di eiezione, associate all'età[77].
Per i pazienti operati per mixoma, il rischio di recidiva del rigurgito, evidenziato da ecocardiografia postoperatoria dopo un mese, 5 anni e 8 anni dopo l'intervento, è di circa il 94%, 58% e il 27% rispettivamente. La ragione dell'alto numero di recidive può essere dovuta all'insoddisfacente riparazione chirurgica, dovuta al processo degenerativo della valvola mitrale mixomatosa[78].
Prevenzione
Come è stato più volte ripetuto, il prolasso mitralico è molto spesso asintomatico, pertanto le raccomandazioni possono essere distinte in generali e specifiche:
- generali: astensione dal fumo, attenzione all'assunzione di anticoncezionali, poiché in taluni soggetti predisposti da possibile co-presenza di coagulopatia[1] può provocare trombosi, attenzione al peso, praticare regolare attività fisica;
- specifiche: utilizzo della profilassi antibiotica a seconda del rischio di endocardite:
- elevato in portatori di protesi valvolare cardiaca,
- moderato in portatori di prolasso mitralico con insufficienza valvolare,
- basso nei portatori di prolasso senza insufficienza, asintomatici.
In genere è raccomandabile l'utilizzo della profilassi antibiotica nelle cure dentarie[79], in procedure come broncoscopie e colonscopie, e biopsie[80][81].
Gravidanza
Il prolasso della mitrale si presenta più frequentemente in donne giovani e fertili. Spesso è un'anomalia congenita isolata, ma a volte, come già detto, si associa alla sindrome di Marfan o altra patologia congenita[19].
Le pazienti con prolasso generalmente non presentano problemi durante la gravidanza: l'aumento relativo delle camere ventricolari durante la gestazione riduce la discrepanza tra la valvola e il ventricolo, cosicché le gravide asintomatiche non richiedono alcun trattamento specifico[82] oltre alla profilassi antibiotica durante il parto, quando l'endocardite batterica può diventare una possibile complicanza[83].
Nelle pazienti con aritmie, vengono spesso usati i betabloccanti[84]. Raramente, le pazienti gravide si complicano con un'embolia sistemica o polmonare, tanto da dover utilizzare una terapia anticoagulante[83].
Le pazienti dovranno essere rassicurate sul fatto che questa patologia valvolare è generalmente benigna[82] e saranno seguite con l'ecocardiografia durante tutta la gestazione, ponendo grande attenzione all'eventuale variazione del rigurgito, se presente già prima della gravidanza[85].
Prolasso valvolare mitralico negli atleti
Nell'ambito della medicina dello sport, la valutazione degli agonisti con prolasso valvolare mitralico è più un problema medico-legale che clinico, poiché deve essere rilasciata certificazione di idoneità all'attività agonistica.[86]
Alcuni studi con follow-up clinici anche di alcuni anni hanno indicato come la valvulopatia mitralica legata al prolasso sia una cardiopatia sostanzialmente benigna e non influenzi in ambito sportivo le prestazioni atletiche, che possono essere anche di elevato livello. Nonostante ciò si possono associare alcune complicanze, spesso aritmiche, e per tale motivo la concessione dell'idoneità sportiva a soggetti portatori di prolasso valvolare mitralico è subordinata a un preciso protocollo di studio.[86]
Debbono essere considerati portatori di prolasso valvolare a rischio, e quindi esclusi dall'attività agonistica, gli atleti con:
- sincopi[87], familiarità per morte cardiaca improvvisa giovanile[88], sindrome del QT lungo[89][90];
- rigurgito mitralico di grado da moderato a severo[59];
- tachiaritmie sopraventricolari recidivanti o aritmie ventricolari complesse a riposo e/o da sforzo.[91]
La classificazione delle attività sportive in relazione all'impegno del sistema cardiocircolatorio è basata principalmente sull'analisi della frequenza cardiaca e della pressione arteriosa, insieme a tre indici fondamentali: le resistenze periferiche, la gittata cardiaca e il grado di stimolazione adrenergica, legata anche a influenze emozionali durante le gare sportive.[92] Le variazioni di frequenza cardiaca, resistenze periferiche e gittata cardiaca hanno permesso di identificare quattro gruppi: «Gruppo A-B-C» con impegno cardiovascolare ridotto, «Gruppo D» con impegno da medio a elevato.[92]
Nei soggetti con aspetto mixomatoso e ridondante dei lembi valvolari, ma con rigurgito mitralico lieve, potrà essere considerata l'idoneità agonistica per sport del gruppo A e del gruppo B, come la vela e gli sport equestri[86]. Sono consigliati controlli cardiologici semestrali, poiché il prolasso può subire un'alterazione anatomica e funzionale in rapporto al possibile progredire della degenerazione mucoide e alla possibilità di alterazioni e rottura delle corde tendinee.[92]
Il prolasso mitralico negli animali
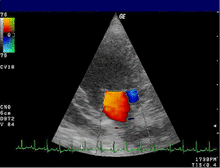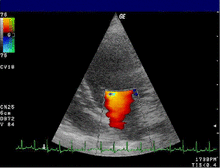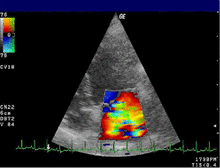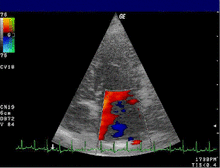
La valvulopatia mitralica è la patologia acquisita cronica più frequente nei cani, costituendo dal 70% all'80% di tutte le cardiopatie canine[93][94].
Con l'avvento dell'ecocardiografia le diagnosi si sono moltiplicate, rispetto alle precedenti tecniche utilizzate come il cateterismo cardiaco e l'angiografia.
La prevalenza è maggiore nei cani di piccola taglia (barboncini, bassotti, chihuahua e meticci) e compare intorno agli 8-11 anni di vita. Alcuni studi hanno evidenziato problemi anche in una razza normalmente fra le non più colpite come il Cavalier King Charles Spaniel.[95]
Recenti studi hanno evidenziato come gli stress meccanici, possano determinare la messa in circolo di alcune sostanze che favoriscono la degenerazione mixomatosa: una di queste sostanze, la serotonina, pare svolga un ruolo primario.[96] Le modalità dell'attivazione neuro-ormonale e il momento in cui questa avviene nel corso della malattia, sono ancora motivi di controversia.
La cardiochirurgia riparativa o sostitutiva della valvola è stata introdotta di recente nella pratica clinica, ma appare promettente e risolutiva al pari di quella umana.[96]
Sono stati riportati dei casi di endocardite batterica in personale medico-veterinario affetto da prolasso mitralico: il germe patogeno sarebbe stato contratto durante la routine lavorativa e secondario a morsi o graffi inusuali[97].
Note
- ^ a b c d e f g h Hurst, pp. 1715-1724.
- ^ Hurst, p. 1715.
- ^ a b (EN) J.B. Barlow, W.A. Pocok, P. Marchand e M. Denny, The significance of late systolic murmurs, in Am Heart J, vol. 66, n. 4, 1963, pp. 443-452.
- ^ a b (EN) J.B. Barlow e C.K. Bosman, Aneurysmal protrusion of the posterior leaflet of the mitral valve. An auscultatory-electrocardiographic syndrome., in Am Heart J, vol. 71, n. 2, 1966, pp. 166-78, PMID 4159172.
- ^ a b (EN) R.P. Lewis, C.F. Wooley, A.J. Kolibash e H. Boudoulas, The mitral valve prolapse epidemic: fact or fiction., in Trans Am Clin Climatol Assoc, vol. 98, 1987, pp. 222-36, PMID 3303618..
- ^ a b (EN) K.D. Boudoulas e H. Boudoulas, Floppy mitral valve (FMV)/mitral valve prolapse (MVP) and the FMV/MVP syndrome: pathophysiologic mechanisms and pathogenesis of symptoms., in Cardiology, vol. 126, n. 2, 2013, pp. 69-80, DOI:10.1159/000351094, PMID 23942374.
- ^ a b c d e f g h E. Amici et al., Rassegna Il prolasso valvolare mitralico (PDF), in G Ital Cardiol, vol. 7, gennaio 2006, pp. 4-22. URL consultato il 5 giugno 2014.
- ^ a b c Hurst, p. 1716.
- ^ a b (EN) A. Carpentier et al., Reconstructive surgery of mitral valve incompetence: ten-year appraisal, in J Thorac cardiovsc Surgery, vol. 79, n. 3, marzo 1980, pp. 338-348, PMID 7354634.
- ^ (EN) R. Pecoraro et al., Staphylococcus lugdunensis Endocarditis Complicated by Embolism in an 18-Year-Old Woman with Mitral Valve Prolapse, in Case Rep Infect Dis., vol. 2013, 2013, PMID 23424690.
- ^ (EN) P. Kligfield et al., Arrhythmias and sudden death in mitral valve prolapse., in Am Heart J, vol. 113, n. 5, maggio 1987, pp. 1298-1307, PMID 3554947.
- ^ a b c (EN) L.A. Freed et al., Prevalence and clinical outcome of mitral-valve prolapse., in N England J of Med, vol. 341, n. 1, luglio 1999, pp. 1-7, PMID 10387935.
- ^ a b (EN) J.P. =Dal-Bianco e R.A. Levine, Anatomy of the mitral valve apparatus: role of 2D and 3D echocardiography, in Cardiol Clin, vol. 31, n. 2, maggio 2013, pp. 151-64, DOI:10.1016/j.ccl.2013.03.001, PMC 3856635, PMID 23743068.
- ^ (EN) D. Levy e D. Savage, Prevalence and clinical features of mitral valve prolapse., in Am Heart J, vol. 113, n. 5, 1987, pp. 1281-90, PMID 3554946.
- ^ (EN) E. Hayek, C.N. Gring e B.P. Griffin, Mitral valve prolapse, in Lancet, vol. 365, n. 9458, 2005, pp. 507-18, DOI:10.1016/S0140-6736(05)17869-6, PMID 15705461.
- ^ (ES) T.O. Cheng, Mitral valve prolapse is a frequent cardiovascular finding in patients with anorexia nervosa, in Rev Esp Cardiol, vol. 56, n. 12, dicembre 2003, p. 1246, PMID 14670280.
- ^ (EN) K. Sauls et al., Developmental basis for filamin-A-associated myxomatous mitral valve disease, in Cardiovasc. Res., vol. 96, n. 1, ottobre 2012, pp. 109-19, DOI:10.1093/cvr/cvs238, PMC 3444235, PMID 22843703.
- ^ (EN) M.H. Davari et al., Cardiovascular Manifestation of a Family with Marfan's Syndrome, in J Tehran Heart Cent, vol. 6, n. 1, 2011, pp. 37-40, PMC 3466859, PMID 23074603.
- ^ a b (EN) R.O. Bonow et al., ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): developed in collaboration with the Society of Cardiovascular Anesthesiologists: endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons, in Circulation, vol. 114, n. 5, agosto 2006, pp. e84–231, DOI:10.1161/CIRCULATIONAHA.106.176857, PMID 16880336.
- ^ a b Testut e Latarjet, pp. 511-513.
- ^ a b Valvola mitrale, su cardio-chirurgia.com. URL consultato il 6 novembre 2014.
- ^ Testut e Latarjet, p. 513.
- ^ Anatomia della valvola mitrale (PDF), su giorgiogolia.it. URL consultato il 6 novembre 2014 (archiviato dall'url originale il 28 luglio 2014).
- ^ (EN) P. Whittaker et al., Quantitative structural analysis of collagen in chordae tendineae and its relation to floppy mitral valves and proteoglycan infiltration, in Br Heart J, vol. 57, n. 3, marzo 1987, pp. 264-9, PMC 1216423, PMID 3566985.
- ^ (EN) R. Mahimkar et al., Cardiac transgenic matrix metalloproteinase-2 expression induces myxomatous valve degeneration: a potential model of mitral valve prolapse disease, in Cardiovasc. Pathol., vol. 18, n. 5, 2009, pp. 253-61, DOI:10.1016/j.carpath.2008.08.001, PMC 3367668, PMID 18835790.
- ^ (EN) D.N. Cağdaş e F.A. Paç, A case of cardiac valvular dysplasia, in Anadolu Kardiyol Derg, vol. 9, n. 6, dicembre 2009, pp. E22–3, PMID 19965310.
- ^ (EN) E.E. van der Wall e M.J. Schalij, Mitral valve prolapse: a source of arrhythmias?, in Int J Cardiovasc Imaging, vol. 26, n. 2, febbraio 2010, pp. 147-9, DOI:10.1007/s10554-009-9540-4, PMC 2817081, PMID 20175294.
- ^ (EN) R.B. Devereux et al., Mitral valve prolapse: causes, clinical manifestations, and management, in Ann. Intern. Med., vol. 111, n. 4, agosto 1989, pp. 305-17, PMID 2667419.
- ^ (EN) K.M. Kessler, Prolapse paranoia, in J. Am. Coll. Cardiol., vol. 11, n. 1, gennaio 1988, pp. 48-9, PMID 3335705.
- ^ (EN) L.A. Freed et al., A locus for autosomal dominant mitral valve prolapse on chromosome 11p15.4, in Am. J. Hum. Genet., vol. 72, n. 6, giugno 2003, pp. 1551-9, DOI:10.1086/375452, PMC 1180315, PMID 12707861.
- ^ (EN) F. Nesta et al., New locus for autosomal dominant mitral valve prolapse on chromosome 13: clinical insights from genetic studies, in Circulation, vol. 112, n. 13, settembre 2005, pp. 2022-30, DOI:10.1161/CIRCULATIONAHA.104.51693, PMID 16172273.
- ^ (EN) A.G. Motulsky, Sounding board. Biased ascertainment and the natural history of diseases, in N. Engl. J. Med., vol. 298, n. 21, maggio 1978, pp. 1196-7, DOI:10.1056/NEJM197805252982111, PMID 651950.
- ^ a b (EN) A. Zuppiroli et al., Natural history of mitral valve prolapse, in Am. J. Cardiol., vol. 75, n. 15, maggio 1995, pp. 1028-32, PMID 7747683.
- ^ a b (EN) A.R. Marks et al., Identification of high-risk and low-risk subgroups of patients with mitral-valve prolapse, in N. Engl. J. Med., vol. 320, n. 16, aprile 1989, pp. 1031-6, DOI:10.1056/NEJM198904203201602, PMID 2927482.
- ^ (EN) G.S. Bisset et al., Clinical spectrum and long-term follow-up of isolated mitral valve prolapse in 119 children, in Circulation, vol. 62, n. 2, agosto 1980, pp. 423-9, PMID 6772335.
- ^ (EN) Z. Vered et al., Mitral valve prolapse. Quantitative analysis and long-term follow-up, in Isr. J. Med. Sci., vol. 21, n. 8, agosto 1985, pp. 644-8, PMID 4044229.
- ^ A. Zuppiroli et al., "Natural histories" of mitral valve prolapse. Influence of patient selection on cardiovascular event rates, in Ital Heart J, vol. 2, n. 2, febbraio 2001, pp. 107-14, PMID 11256537.
- ^ (EN) N.D. Caltrider et al., Retinal emboli in patients with mitral valve prolapse, in Am. J. Ophthalmol., vol. 90, n. 4, ottobre 1980, pp. 534-9, PMID 7424751.
- ^ (EN) M.H. Seelenfreund et al., Mitral valve prolapse (Barlow's syndrome) and retinal emboli, in Metab Pediatr Syst Ophthalmol, vol. 11, n. 3, 1988, pp. 119-21, PMID 3205165.
- ^ (EN) F. van Rhee et al., Bilateral retinal artery occlusion due to mitral valve prolapse, in Br J Ophthalmol, vol. 75, n. 7, luglio 1991, pp. 436-7, PMC 1042415, PMID 1854701.
- ^ a b Hurst, p. 1722.
- ^ (EN) T.A. Elhussein, S.J. Hutchison e N. Said, Unique congenital malformation of the mitral valve associated with anomalous coronary arteries and stroke, in J Cardiovasc Ultrasound, vol. 22, n. 1, marzo 2014, pp. 43–5, DOI:10.4250/jcu.2014.22.1.43, PMC 3992349, PMID 24753810.
- ^ (EN) Kligfield et al., Complex arrhythmias in mitral regurgitation with and without mitral valve prolapse: contrast to arrhythmias in mitral valve prolapse without mitral regurgitation, in Am. J. Cardiol., vol. 55, n. 13, giugno 1985, pp. 1545-9, PMID 4003297.
- ^ (EN) F. Grigioni et al., Atrial fibrillation complicating the course of degenerative mitral regurgitation: determinants and long-term outcome, in J. Am. Coll. Cardiol., vol. 40, n. 1, luglio 2002, pp. 84-92, PMID 12103260.
- ^ (EN) A. D'aloia et al., Mitral valve prolapse and conduction disturbances: the forgotten association, in Cardiovasc J Afr, vol. 21, n. 6, 2010, pp. 327-9, PMID 21135981.
- ^ (EN) C.S. Sriram et al., Malignant bileaflet mitral valve prolapse syndrome in patients with otherwise idiopathic out-of-hospital cardiac arrest, in J. Am. Coll. Cardiol., vol. 62, n. 3, luglio 2013, pp. 222-30, DOI:10.1016/j.jacc.2013.02.060, PMID 23563135.
- ^ (EN) JB Barlow et al., Billowing, floppy, prolapsed or flail mitral valve?, in Am J Cardiol, vol. 55, febbraio 1985, pp. 501-2.
- ^ (EN) R.B. Devereux et al., Diagnosis and classification of severity of mitral valve prolapse: methodologic, biologic, and prognostic considerations (abstract), in Am J Heart, vol. 113, 1987, pp. 1265-80, PMID 3554945.
- ^ (EN) G.I. Tagarakis et al., Classic and non-classic forms of mitral valve prolapse, in Anadolu Kardiyol Derg, vol. 12, n. 1, febbraio 2012, pp. 2-4, DOI:10.5152/akd.2012.001, PMID 22214735.
- ^ a b Hurst, p. 1717.
- ^ a b Hurst, p. 1718.
- ^ (EN) D.G. Gibson e D.J. Brown, Abnormal left ventricular wall movement in patients with chest pain and normal coronary arteriograms. Relation to inferior T wave changes and mitral prolapse, in Br Heart J, vol. 41, n. 4, aprile 1979, pp. 385-91, PMC 482044, PMID 465205.
- ^ (EN) D. Dursunoğlu, H. Evrengül e E. Semiz, [Mitral valve prolapse syndrome: orthostatic hypotension and physiopathology of its clinical symptomathologies], in Anadolu Kardiyol Derg, vol. 3, n. 1, marzo 2003, pp. 60-4, PMID 12626313.
- ^ (EN) T. Strecker e A. Agaimy, Giant left atrial myxoma causing drop attacks by prolapsing into the mitral valve, in Int J Clin Exp Pathol, vol. 5, n. 9, 2012, pp. 996-9, PMC 3484485, PMID 23119119.
- ^ (EN) F. Migliore et al., Prevalence of cardiomyopathy in Italian asymptomatic children with electrocardiographic T-wave inversion at preparticipation screening, in Circulation, vol. 125, n. 3, gennaio 2012, pp. 529-38, DOI:10.1161/CIRCULATIONAHA.111.055673, PMID 22179535.
- ^ a b c Hurst, p. 1719.
- ^ (EN) A.P. Michaelides et al., ST-Segment Depression in Hyperventilation Indicates a False Positive Exercise Test in Patients with Mitral Valve Prolapse, in Cardiol Res Pract, vol. 201, 2010, pp. 541-781, DOI:10.4061/2010/541781, PMC 2990857, PMID 21113438.
- ^ (EN) M.M. Peighambari et al., Electrocardiographic changes in mitral valve prolapse syndrome, in J Cardiovasc Thorac Res, vol. 6, n. 1, 2014, pp. 21-3, DOI:10.5681/jcvtr.2014.004, PMC 3992727, PMID 24753827.
- ^ a b (EN) A.K. Steriotis et al., Noninvasive cardiac screening in young athletes with ventricular arrhythmias, in Am. J. Cardiol., vol. 111, n. 4, febbraio 2013, pp. 557-62, DOI:10.1016/j.amjcard.2012.10.044, PMC 3569714, PMID 23219000.
- ^ Hurst, p. 1720.
- ^ (EN) Lee A.P. et al., Quantitative analysis of mitral valve morphology in mitral valve prolapse with real-time 3-dimensional echocardiography: importance of annular saddle shape in the pathogenesis of mitral regurgitation, in Circulation, vol. 127, n. 7, febbraio 2013, pp. 832-41, DOI:10.1161/CIRCULATIONAHA.112.118083, PMID 23266859.
- ^ (EN) A. Eyal et al., Pre-operative systolic anterior motion of the mitral valve in a patient undergoing mitral valve repair, in Eur Heart J Acute Cardiovasc Care, vol. 2, n. 1, marzo 2013, pp. 88-95, DOI:10.1177/2048872613475890, PMC 3760582, PMID 24062939.
- ^ Hurst, pp. 1720-1721.
- ^ Ruolo e timing della cardiochirurgia nel prolasso mitralico. Indicazioni, tecniche operatorie, risultati (PDF), su sicoa.net. URL consultato il 6 novembre 2014 (archiviato dall'url originale il 14 luglio 2014).
- ^ (EN) R.S. Gabriel et al., Mapping of mitral regurgitant defects by cardiovascular magnetic resonance in moderate or severe mitral regurgitation secondary to mitral valve prolapse, in J Cardiovasc Magn Reson, vol. 10, 2008, p. 16, DOI:10.1186/1532-429X-10-16, PMC 2324092, PMID 18400088.
- ^ (EN) B. Ritwick et al., Minimally Invasive Mitral Valve Procedures: The Current State, in Minim Invasive Surg, vol. 201, 2013, p. 8, DOI:10.1155/2013/679276, PMC 3870135, PMID 24382998.
- ^ (EN) L.H. Cohn e J.G. Byrne, Minimally invasive mitral valve surgery: current status, in Tex Heart Inst J, vol. 40, n. 5, 2013, pp. 575-6, PMC 3853829, PMID 24391326.
- ^ (PT) J.V. Castro Neto et al., Minimally invasive procedures - direct and video-assisted forms in the treatment of heart diseases, in Arq. Bras. Cardiol., vol. 102, n. 3, marzo 2014, pp. 219-25, DOI:10.5935/abc.20140004, PMC 3987317, PMID 24553983.
- ^ Hurst, p. 1724.
- ^ (EN) O.A. Vengen et al., Outcome of mitral valve plasty or replacement: atrial fibrillation an effect modifier, in J Cardiothorac Surg, vol. 8, n. 1, giugno 2013, p. 142, DOI:10.1186/1749-8090-8-142, PMC 3673869, PMID 23724788.
- ^ (EN) A. Lio et al., Mitral valve repair versus replacement in patients with ischaemic mitral regurgitation and depressed ejection fraction: risk factors for early and mid-term mortality, in Interact Cardiovasc Thorac Surg, marzo 2014, DOI:10.1093/icvts/ivu066, PMID 24676552.
- ^ (EN) R. García Fuster et al., Artificial chordae in the setting of complex mitral valve repair: early outcomes using the folding leaflet technique, in Interact Cardiovasc Thorac Surg, vol. 18, n. 5, maggio 2014, pp. 586-95, DOI:10.1093/icvts/ivu013, PMID 24525854.
- ^ (EN) P. Gaur et al., Mitral valve repair versus replacement in the elderly: Short-term and long-term outcomes, in J. Thorac. Cardiovasc. Surg., gennaio 2014, DOI:10.1016/j.jtcvs.2014.01.032, PMID 24589201.
- ^ (EN) Suri R.M. e H.M. Burkhart, Optimizing outcomes of robotic mitral valve repair for all prolapse anatomy: the Suri-Burkhart technique, in Ann Cardiothorac Surg, vol. 2, n. 6, novembre 2013, pp. 841-845, DOI:10.3978/j.issn.2225-319X.2013.10.05, PMC 3857047, PMID 24349993.
- ^ (EN) M.A. Acker et al., Surgery for severe ischemic mitral regurgitation, in N. Engl. J. Med., vol. 370, n. 15, aprile 2014, p. 1463, DOI:10.1056/NEJMc1401885, PMID 24716690.
- ^ (EN) J.F. Avierinos et al., Natural history of asymptomatic mitral valve prolapse in the community, in Circulation, vol. 106, n. 11, settembre 2002, pp. 1355-61, PMID 12221052.
- ^ (JA) Y. Doi et al., Clinical profile and prognosis of mitral valve prolapse: influence of aging to the complications, in Nihon Ronen Igakkai Zasshi, vol. 25, n. 5, settembre 1988, pp. 474-9, PMID 3210359.
- ^ Hurst, p. 1723.
- ^ (EN) F.Y. Chee e C.H. How, Doctor, my dentist wants your opinion, in Singapore Med J, vol. 54, n. 1, gennaio 2013, pp. 11-3, PMID 23338910.
- ^ (EN) A.S. Dajani et al., Prevention of bacterial endocarditis: recommendations by the American Heart Association, in Clin. Infect. Dis., vol. 25, n. 6, dicembre 1997, pp. 1448-58, PMID 9431393.
- ^ (EN) B.D. Weiss, Management of MVP with antibiotic prophylaxis, in Am Fam Physician, vol. 64, n. 1, luglio 2001, p. 36, PMID 11456436.
- ^ a b Hurst, p. 2156.
- ^ a b Malattie cardiache in gravidanza, su msd-italia.it. URL consultato il 20 agosto 2014 (archiviato dall'url originale il 4 febbraio 2013).
- ^ Opie, pp. 19-20.
- ^ (EN) V. Regitz-Zagrosek et al., ESC Guidelines on the management of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC), in Eur. Heart J., vol. 32, n. 24, dicembre 2011, pp. 3147-97, DOI:10.1093/eurheartj/ehr218, PMID 21873418.
- ^ a b c Protocolli cardiologici per il giudizio di idoneità allo sport agonistico COCIS 2009-Valvulopatie, su ambrosiafitness.it. URL consultato il 23 agosto 2014 (archiviato dall'url originale il 15 dicembre 2014).
- ^ (EN) F. Colivicchi et al., Exercise-related syncope in young competitive athletes without evidence of structural heart disease. Clinical presentation and long-term outcome, in Eur. Heart J., vol. 23, n. 14, luglio 2002, pp. 1125-30, PMID 12090751.
- ^ (EN) C. Basso et al., Cardiovascular causes of sudden death in young individuals including athletes, in Cardiol Rev, vol. 7, n. 3, 1999, pp. 127-35, PMID 10423663.
- ^ (EN) C.E. Lawless e T.M. Best, Electrocardiograms in athletes: interpretation and diagnostic accuracy, in Med Sci Sports Exerc, vol. 40, n. 5, maggio 2008, pp. 787-98, DOI:10.1249/MSS.0b013e318164dd18, PMID 18408622.
- ^ (EN) G. Markiewicz-Łoskot et al., Electrocardiographic abnormalities in young athletes with mitral valve prolapse, in Clin Cardiol, vol. 32, n. 8, agosto 2009, pp. E36–9, DOI:10.1002/clc.20398, PMID 19455568.
- ^ (EN) A. Garson, Arrhythmias and sudden cardiac death in elite athletes. American College of Cardiology, 16th Bethesda Conference, in Pediatr Med Chir, vol. 20, n. 2, 1998, pp. 101-3, PMID 9706632.
- ^ a b c Protocolli cardiologici per il giudizio di idoneità allo sport agonistico COCIS 2009-Classificazione, su ambrosiafitness.it. URL consultato il 23 agosto 2014 (archiviato dall'url originale il 15 dicembre 2014).
- ^ (EN) H.G. Parker e P. Kilroy-Glynn, Myxomatous mitral valve disease in dogs: does size matter?, in J Vet Cardiol, vol. 14, n. 1, marzo 2012, pp. 19-29, DOI:10.1016/j.jvc.2012.01.006, PMC 3307894, PMID 22356836.
- ^ (EN) H.D. Pedersen e J. Häggström, Mitral valve prolapse in the dog: a model of mitral valve prolapse in man, in Cardiovasc. Res., vol. 47, n. 2, agosto 2000, pp. 234-43, PMID 10946060.
- ^ (EN) H.D. Pedersen et al., Mitral valve prolapse in 3-year-old healthy Cavalier King Charles Spaniels. An echocardiographic study, in Can. J. Vet. Res., vol. 59, n. 4, ottobre 1995, pp. 294-8, PMC 1263784, PMID 8548691.
- ^ a b S. Crosara e M. Borgarelli, La malattia valvolare mitralica cronica nel cane, su veterinaria.scivac.org. URL consultato il 22 febbraio 2018 (archiviato dall'url originale il 23 febbraio 2018).
- ^ (EN) R.L. Oehler et al., Bite-related and septic syndromes caused by cats and dogs, in Lancet Infect Dis, vol. 9, n. 7, luglio 2009, pp. 439-47, DOI:10.1016/S1473-3099(09)70110-0, PMID 19555903.
Bibliografia
- Léo Testut e André Latarjet, Miologia-Angiologia, in Trattato di anatomia umana. Anatomia descrittiva e microscopica – Organogenesi, vol. 2, 5ª ed., Torino, UTET, 1973, ISBN non esistente.
- Douglas M. Anderson, A. Elliot Michelle, Mosby’s medical, nursing, & Allied Health Dictionary, 6ª ed., New York, Piccin, 2004, ISBN 88-299-1716-8.
- Sergio Dalla Volta, L. Daliento, R. Razzolini, Malattie del cuore e dei vasi, 3ª ed., Milano, McGraw-Hill, 2005, ISBN 88-386-2994-3.
- Tinsley Randolph Harrison, Principi di medicina interna (il manuale), 16ª ed., New York, Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3.
- Joseph C. Segen, Concise Dictionary of Modern Medicine, New York, McGraw-Hill, 2006, ISBN 978-88-386-3917-3.
- Eugene Braunwald, Peter Libby, Robert O. Bonow, Douglas P. Zipes, Douglas L. Mann, Braunwald's Heart Disease. A textbook of cardiovascular medicine, 8ª ed., Saunders Elsevier, 2008, ISBN 978-1-4160-4105-4.
- John Willis Hurst, Il cuore, 12ª ed., Milano, McGraw-Hill, 2009, ISBN 978-88-386-3943-2.
- Ettore Bartoli, Medicina interna: metodologia, semeiotica, fisiopatologia, clinica, terapia medica, Genova, Restless Architect of Human Possibilities sas (R.A.H.P. sas), 2010, ISBN 978-88-904381-1-0.
- Luigi Badano, M. Galderisi, D. Muraru, S. Mondillo, Ecocardiografia multiplanare e tridimensionale real-time, Livorno, MB&Care Health and Science Publishing, 2011, ISBN 978-88-902384-1-3.
- Lionel H. Opie, Gersh Bernard J., Farmaci per il cuore, 8ª ed., Milano, Edra, 2014, ISBN 978-88-214-3768-7.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su sindrome da prolasso valvolare mitralico
Wikimedia Commons contiene immagini o altri file su sindrome da prolasso valvolare mitralico
Collegamenti esterni
- (EN) Prolasso valvolare mitralico, su watchlearnlive.heart.org.
- (EN) Terapia chirurgica mini invasiva nella riparazione della valvola mitrale, su cardiac.broadcastmed.com. URL consultato il 16 giugno 2014 (archiviato dall'url originale il 24 dicembre 2014).
- (EN) Terapia chirurgica mini invasiva: riparazione mitralica con supporto robotico, su orlive.com. URL consultato il 16 giugno 2014 (archiviato dall'url originale il 29 aprile 2014).
- (EN) Riparazione chirurgica della valvola mitrale, su orlive.com. URL consultato il 16 giugno 2014 (archiviato dall'url originale il 7 novembre 2014).
