Farmacogenetica
| Deel van een serie artikelen over |

|
|---|
| Stuifmeelcellen in meiose
|
| ––– Algemeen ––– |
|
Chromosoom · DNA · Erfelijkheid · Genetische variatie · Genoom · Mutatie · Nucleotide · RNA |
| ––– Onderzoek ––– |
|
DNA-analyse · Gentechnologie · Genomica · Sequencing |
| ––– Vakgebieden ––– |
| Epigenetica · Klinische genetica · Mendel · Moleculaire genetica · Populatiegenetica |
|
|
| Portaal |
Farmacogenetica is het wetenschappelijk vakgebied waarbinnen onderzoek wordt gedaan naar variaties in het DNA die de reactie van een individu op een medicijn kunnen beïnvloeden; dit geldt voor zowel het therapeutische effect van het medicijn als de mogelijke bijwerkingen die het medicijn kan veroorzaken.
Omschrijving
Elk mens heeft uniek DNA, dat op verschillende punten verschilt van andere mensen. Variaties binnen een coderend stuk DNA worden polymorfismes genoemd. Op één plaats in het genoom kan men bij verschillende mensen een ander nucleotide aantreffen, een SNP genaamd. Als een SNP minder vaak voorkomt, wordt dit een "minor allele" genoemd. Het hebben van een SNP is vaak onschuldig, maar op sommige cruciale plaatsen in het DNA kan dit gevolgen hebben voor bijvoorbeeld het metabolisme van een bepaald medicijn. Dit zorgt voor verschillen tussen mensen in reactie op medicatie.
De termen farmacogenetica en farmacogenomica worden vaak als hetzelfde gezien, en een precieze definitie van beide termen blijft lastig te vormen. Over het algemeen wordt farmacogenetica gezien als het onderzoek naar genetische informatie die ervoor zorgt dat er verschillende reacties zijn op medicijnen, terwijl farmacogenomica meer over de applicatie van genomische technologieën op het ontdekken van nieuwe medicijnen en het verbeteren van bestaande medicijnen gaat.
Effect op farmacokinetiek en farmacodynamiek
Genetische variatie kan invloed hebben op de farmacokinetiek (wat doet het lichaam met een geneesmiddel) en farmacodynamiek (wat doet het geneesmiddel met het lichaam). Beide mogelijkheden worden hier toegelicht.
Farmacogenetica en farmacokinetiek
Onder farmacokinetiek worden enkele processen verstaan waaraan het geneesmiddel wordt onderworpen als het in het lichaam komt, zoals opname in het lichaam, verdeling over het lichaam, afbraak en uitscheiding. De afbraak of metabolisme van geneesmiddelen vindt vooral plaats in de lever door enzymen waarna het afgebroken middel veelal wordt uitgescheiden door de nieren. De afbraaksnelheid van het geneesmiddel is dus sterk afhankelijk van de activiteit van de betrokken leverenzymen. Deze leverenzymen bestaan voornamelijk uit de cytochroom p450 enzymen. Deze enzymen worden gecodeerd door genen waarbij in de populatie variatie voorkomt. Voor de CYP450 enzymen worden drie en in sommige gevallen vier fenotypen onderscheiden:
- Poor metabolizers
- Intermediate metabolizers
- Extensive metabolizers
- Ultra-rapid metabolizers
Extensive metabolizers, hebben een normaal metabolisme en komen het vaakst voor in de populatie; de standaarddosering van een geneesmiddel is bij deze groep meestal werkzaam zonder bijwerkingen. Poor metabolizers hebben een genetische variant die codeert voor een defect of verminderd actief enzym wat leidt tot verhoogde concentraties van het geneesmiddel in het bloed bij een normale dosis in vergelijking met extensive metabolizers. Te hoge concentraties van een geneesmiddel kunnen leiden tot bijwerkingen. Intermediate metabolizers hebben een genetische variant die codeert voor een verminderd actief enzym en dit kan ook leiden tot verhoogde plasmaconcentraties en bijwerkingen maar minder dan bij de poor metabolizers. Ultra-rapid metabolizers hebben juist meer of actiever enzym en zijn zeer effectief in het afbreken van medicatie. Dit leidt tot een lagere concentratie van het geneesmiddel in het bloed en minder of zelfs geen effect.
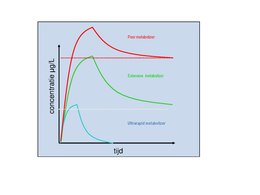
Met behulp van genetische testen kan per leverenzym worden bepaald in welke categorie een individu valt, waarna de geneesmiddel dosis kan worden aangepast, zodat een plasmaconcentratie binnen de therapeutische index bereikt kan worden. Sommige geneesmiddelen zijn juist past werkzaam na omzetting door leverenzymen; bij deze zogenaamde prodrugs hebben poor metabolizers juist een verminderde omzetting met als gevolg een lagere concentratie van de werkzame metaboliet en een verminderde respons op de medicatie. In geval van een prodrug hebben ultrarapid metabolizers juist een hogere blootstelling aan de werkzame metaboliet. Een voorbeeld van een CYP enzym waarvan genetische varianten van invloed zijn op de enzymactiviteit en de farmacokinetiek van geneesmiddelen is CYP2D6. CYP2D6 is een leverenzym dat betrokken is bij de afbraak van ~30% van de verkrijgbare geneesmiddelen in Nederland. Door bij het bepalen van de dosis rekening te houden met het genotype kan een te hoge (bijwerkingen) en te lage (ineffectiviteit) blootstelling worden voorkomen. Een voorbeeld is het antidepressivum amitriptyline, waarvan poor metabolizers zonder functioneel enzym 50% van de standaarddosering nodig hebben, intermediate metabolizers 60% en ultrarapid metabolizers 125%.
Farmacogenetica en farmacodynamiek
Farmacodynamiek (wat doet het geneesmiddel met het lichaam) betreft de werkingsmechanismen van het geneesmiddel op het niveau van receptoren, enzymen of ionkanalen. Genetica speelt hier ook een rol in: door bepaalde variaties kan er overexpressie zijn van bijvoorbeeld een receptor waardoor die overmatig aanwezig is en het geneesmiddelrespons hierdoor groter wordt. Ook kan een receptor van vorm veranderd zijn waardoor een geneesmiddel juist minder goed aangrijpt en het geneesmiddelrespons kleiner wordt. Cumarinederivaten zoals acenocoumarol en fenprocoumon worden gebruikt als antistollingsmiddel bij o.a. boezemfibrilleren en trombosebenen. Farmacokinetisch worden ze omgezet door CYP2C9, wat deels verklaart waarom ze bij de ene patiënt beter werken met minder bijwerkingen dan bij de ander. Farmacodynamisch is ook VKORC1 (vitamine k-2,3-epoxidereductase complex subunit 1) betrokken: dit enzym zet vitamine K om naar zijn geactiveerde vorm die bijdraagt aan bloedstolling. Varianten in dit gen bepalen hoe gevoelig je bent voor een coumarinederivaat en dus ook hoe snel je bijwerkingen krijgt.
Geschiedenis
Rond het jaar 1898 deed de Britse fysicus Archibald E. Garrod (1858-1936) onderzoek naar urinepigmenten. In het Londens St. Bartholomew's Hospital bestudeerde hij patiënten die leden aan alkaptonurie. Garrod ontdekte dat bij de ouders van kinderen die leden aan alkaptonurie vaker bloedverwantschap voorkwam dan gebruikelijk. Deze ontdekking zorgde voor de ontwikkeling van het principe van chemische individualiteit, dat Garrod in 1909 beschreef in The Inborn Errors of Metabolism en in 1931 in The Inborn Factors of Disease.
Pas in de jaren 50 ontwikkelde de farmacogenetica zich als zelfstandige discipline binnen de geneeskunde. Nieuwe technieken brachten de mogelijkheid om met grote nauwkeurigheid enzymatische activiteit te registreren. Door deze technieken ontdekten medisch onderzoekers drie gevallen van genetisch bepaalde variaties in enzymactiviteit bij patiënten die leden aan overgevoeligheidsreacties op bepaalde medicijnen. Dit bevestigde de voorspelling van Garrod.
In 1957 publiceerde Arno Motulsky het artikel Drug reactions, enzymes and biochemical genetics, waarin hij beschreef hoe erfelijke gen-gecontroleerde enzymatische factoren bepalen dat, bij gelijke blootstelling, sommige personen ziek worden en anderen niet. Deze publicatie markeerde het ware begin van farmacogenetica als onderscheidende discipline.
De eerste internationale conferentie voor farmacogenetica werd georganiseerd in 1967. Het bracht onderzoekers van de nieuwe onderzoeksdiscipline samen en de nieuwe ontdekkingen volgden elkaar snel op. De conferenties die erop volgden gaven farmacogenetica bekendheid en zorgden ervoor dat het zich definitief vestigde als medische onderzoeksdiscipline.
Toepassing in de gezondheidszorg
Er zijn verschillende laboratoria in Nederland die een farmacogenetische bepaling uit kunnen voeren. Het gaat onder meer om de volgende onderzoeksmogelijkheden:
Genotypering bij abacavir
Abacavir is een medicijn dat gebruikt wordt bij behandeling van hiv. Ruim 90% van de patiënten kan dit medicijn veilig gebruiken, maar een kleine groep patiënten is overgevoelig voor abacavir. Deze overgevoeligheidsreactie kan zo heftig zijn dat deze fataal kan zijn. Om zeker te weten dat een patiënt niet overgevoelig is voor abacavir worden patiënten gegenotypeerd om zo van tevoren te kunnen bepalen of een patiënt overgevoelig is voor dit medicijn. Door dit genotyperen kunnen ernstige bijwerkingen worden voorkomen. Abacavir is het eerste voorbeeld van een geneesmiddel waarmee door middel van dubbelblind gerandomiseerd onderzoek is aangetoond dat farmacogenetica bijwerkingen kan voorkomen.
Genotypering bij capecitabine en 5-FU
Capecitabine en 5-FU zijn geneesmiddelen die worden gebruikt bij de behandeling van verschillende vormen van kanker. DPYD is het gen dat codeert voor het DPD-enzym, dat verantwoordelijk is voor de afbraak van 5-fluorouracil in de lever. Circa 4% van de kaukasische populatie heeft geen actief DPD enzym en bij een deel van deze mensen is de oorzaak hiervan de DPYD*2A-mutatie in het DPYD gen. Deze mutatie leidt tot een vertraagd metabolisme van 5-FU en hierdoor hogere blootstelling. Dit kan ernstige bijwerkingen tot gevolg hebben, zoals myelosuppressie, ernstige diarree, IC-opname en zelfs overlijden. Deenen et al. heeft onderzoek gedaan naar het voorkómen van ernstige toxiciteit en het blijkt dat prospectief screenen op DPYD*2A met dosisaanpassingen de toxiciteit van 5-FU en capecitabine significant verminderd.
Genotypering bij azathioprine en 6-mercaptopurine
Thiopurinemethyltransferase (TPMT) is betrokken bij het metabolisme van de thiopurines waarvan in Nederland azathioprine en 6-mercaptopurine worden toegepast onder andere bij acute lymfoblastische leukemie bij kinderen, inflammatoire darmziekten en auto-immuunziekten. De enzymactiviteit is sterk variabel en wordt bepaald door het TMPT gen. In de blanke populatie heeft 10,1% een intermediair metabolisme en 0,3% een traag metabolisme. Door de dosis te verlagen met 50% bij intermediair en met 85-90% bij traag metabolisme, is het mogelijk toxiciteit te voorkomen.
Genotypering bij tacrolimus
CYP3A5 genotypering wordt soms toegepast bij het gebruik van tacrolimus. Tacrolimus is een immunosuppressivum dat wordt gebruikt in de transplantatiegeneeskunde om orgaanafstoting te voorkomen. In de kaukasische populatie is de frequentie van het allel dat resulteert in inactief CYP3A5 enzym 80-90%. Dit betekent dat in een kaukasische populatie 10-20% van de personen met een hogere dosis tacrolimus behandelt moet worden.
Richtlijnen
Om de uitkomsten van de genotyperingen te kunnen gebruiken in de kliniek, heeft de Nederlandse Farmacogenetica Werkgroep (Dutch Pharmacogenetics Working Group; DPWG) richtlijnen opgesteld wat betreft dosisaanpassingen voor de varianten.[1] Voor 53 geneesmiddelen en de genen CYP2D6, CYP2C19, CYP2C9, TPMT, DPD, VKORC1, UGT1A1, HLA-B44, HLA-B*5701, CYP3A5 en factor V Leiden heeft de DPWG richtlijnen opgesteld. In de Verenigde Staten is er een vergelijkbare werkgroep genaamd Clinical Pharmacogenetics Implementation Consortium (CPIC) actief.[2] CPIC heeft richtlijnen opgesteld voor 28 gen-geneesmiddel interacties. De CPIC richtlijnen zijn vrij toegankelijk en te vinden op PharmGKB.[3] Een beperking van beide richtlijnen is dat meerdere genen betrokken kunnen zijn bij de farmacokinetiek en farmacodynamiek van een geneesmiddel en hiervoor nog geen adviezen beschikbaar zijn. Een voorbeeld daarvan zijn enkele tricyclische antidepressiva, die zowel door CYP2D6 als CYP2C19 worden afgebroken.
Toekomst
Hoewel sequencetechnieken erg succesvol zijn worden deze technieken nog niet veel gebruikt in de gezondheidszorg. Bij de meeste gen-medicijninteracties wordt er bij een medicijn maar naar één gen gekeken terwijl er vaak meerdere genen betrokken zijn bij de afbraak van een medicijn. Als persoon-specifieke medicatie gebruikelijker zou zijn zou onderzoek met verschillende genen en medicijnen vaker worden gedaan. Met behulp van deze combinatie onderzoeken kunnen ernstige bijwerkingen van medicijnen worden voorkomen bij patiënten die niet het juiste genotype hebben.[4] Door het voorkomen van deze ernstige bijwerkingen kunnen de kosten van medicijnen en zorg in de toekomst verlaagd worden. Ook het op de markt brengen van nieuwe medicatie zal goedkoper worden aangezien het op de markt brengen van een medicijn niet gestopt zal worden omdat er een groot risico is voor een kleine groep in de populatie. Deze subgroep kan van tevoren geïdentificeerd worden en zo kan er een verlaagde dosis gegeven worden of kan blootstelling aan het medicijn voorkomen worden. Door farmacogenetica te gebruiken in de gezondheidszorg kunnen medicijnen veiliger gebruikt worden en zullen patiënten minder last hebben van ernstige bijwerkingen.