Nickel(II) bromide
| Nickel(II) bromide | |
|---|---|
 Cấu trúc của nickel(II) bromide giống cadmi(II) iodide | |
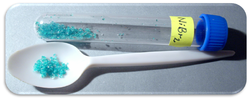 Mẫu nickel(II) bromide hexahydrat | |
| Danh pháp IUPAC | Nickel(II) bromide |
| Tên khác | Nickel dibromide Nikenơ bromide |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | NiBr2 |
| Khối lượng mol | 218,771 g/mol (khan) 254,80156 g/mol (2 nước) 272,81684 g/mol (3 nước) 326,86268 g/mol (6 nước) 380,90852 g/mol (9 nước) |
| Bề ngoài | tinh thể vàng nâu (khan) tinh thể lục lam (6 nước) |
| Mùi | không mùi |
| Khối lượng riêng | 5,098 g/cm³[1] |
| Điểm nóng chảy | 963 °C (1.236 K; 1.765 °F) (thăng hoa, khan) 28,5 °C (83,3 °F; 301,6 K) (6 nước) −2,5 °C (27,5 °F; 270,6 K) (9 nước)[2] |
| Điểm sôi | |
| Độ hòa tan trong nước | 113 g/100 mL (0 ℃) 122 g/100 mL (10 ℃) 134 g/100 mL (25 ℃)[3] 144 g/100 mL (40 ℃) 155 g/100 mL (100 ℃), xem thêm bảng độ tan |
| Độ hòa tan | tạo phức với amonia, hydrazin, urê, thiourê, selenosemicacbazit |
| MagSus | +5600,0·10−6 cm³/mol |
| Các nguy hiểm | |
| Nguy hiểm chính | chất kích thích, ăn mòn |
| NFPA 704 |
|
| Điểm bắt lửa | không bắt lửa |
| Các hợp chất liên quan | |
| Anion khác | Nickel(II) fluoride Nickel(II) chloride Nickel(II) iodide |
| Cation khác | Cobalt(II) bromide Đồng(II) bromide Paladi(II) bromide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Nickel(II) bromide là tên gọi của các hợp chất vô cơ có công thức hóa học NiBr2(H2O)x. Giá trị của x có thể là 0 đối với chất khan, cũng như 2, 3 hoặc 6 đối với ba dạng hydrat đã biết. Chất khan là một chất rắn màu nâu vàng hòa tan trong nước để tạo ra hexahydrat màu lục lam. Nonahydrat cũng đã được xác định là tồn tại, nhưng chỉ ở mức nhiệt độ dưới 0 ℃ (32 ℉; 273,15 K).[2]
Cấu trúc
Cấu trúc của nickel(II) bromide thay đổi theo mức độ hydrat hóa. Trong tất cả các trường hợp này, ion nickel(II) có hình học phân tử bát diện.
- NiBr2 khan, có cấu trúc giống cadmi(II) chloride.[4][5] Khoảng cách tương tác cho Ni–Br là 2,52–2,58 Å.
- Cấu trúc của trihydrat chưa được xác định bằng tinh thể học tia X. Nó được giả định rằng có một cấu trúc chuỗi.[6]
- Các di- và hexahydrat có các cấu trúc gần giống với cấu trúc của các chloride tương ứng. dihydrat bao gồm một chuỗi tuyến tính, trong khi hexahydrat có các phân tử trans-NiBr2(H2O)4 cùng với hai phân tử nước không liên kết.
Phản ứng và ứng dụng
NiBr2 có đặc tính acid Lewis. NiBr2 cũng được sử dụng để điều chế các chất xúc tác cho các phản ứng ghép chéo và các quá trình cacbon hóa khác nhau.[4]
Theo kinh nghiệm, NiBr2-glyme đã cho thấy hoạt động tăng so với NiCl2-glyme đối với một số biến đổi.[7]

An toàn
Nickel(II) có tính độc hại và bị nghi ngờ là tác nhân gây ung thư.[4]
Hợp chất khác
- NiBr2 tác dụng với dung dịch NH3 đặc ở điều kiện thích hợp tạo ra chất rắn màu nâu đen của amin NiBr2·NH3, chất rắn màu nâu đỏ của diamin NiBr2·2NH3,[8] chất rắn màu lục của tetramin NiBr2·4NH3[9] hay tinh thể màu tím của hexamin NiBr2·6NH3. Chất này tan ít trong nước.
- NiBr2 tác dụng với N2H4 ở điều kiện thích hợp tạo ra:
- NiBr2 sẽ tác dụng với CO(NH2)2 ở điều kiện thích hợp tạo ra tinh thể màu lục nhạt của NiBr2·4CO(NH2)2[13] hoặc tinh thể màu lục của NiBr2·10CO(NH2)2.[14]
- NiBr2 sẽ tác dụng với CS(NH2)2 ở điều kiện thích hợp tạo ra tinh thể nâu sáng đến không màu của NiBr2·2CS(NH2)2[15], tinh thể màu vàng kim loại đến vàng của NiBr2·4CS(NH2)2[16] hay tinh thể màu vàng lục đậm của NiBr2·6CS(NH2)2, CAS#: 14976-06-8.[17][ghi chú 1] Phức hai phối tử NiBr2·6CS(NH2)2·3NH3 cũng được biết đến, dưới dạng tinh thể màu dương nhạt.[18]
- NiBr2 sẽ tác dụng với CSN3H5 ở điều kiện thích hợp tạo ra tinh thể NiBr2·2CSN3H5·nH2O là tinh thể lục, CAS#: 53277-11-5[19][ghi chú 1] hay NiBr2·3CSN3H5 là tinh thể màu dương.[20]
- NiBr2 sẽ tác dụng với CSeN3H5 ở điều kiện thích hợp tạo ra NiBr2·2CSeN3H5 là chất rắn màu nâu hay NiBr2·3CSeN3H5·2H2O là bột hoặc tinh thể màu lục, tan nhiều trong nước, không tan trong etanol và ete.[21]
Ghi chú
Tham khảo
- ^ http://chemdat.merck.de/documents/sds/emd/deu/de/8181/818174.pdf
- ^ a b Nickel Dibromide, NiBr2 trên atomistry.com
- ^ http://chemister.ru/Database/properties-en.php?dbid=1&id=3859
- ^ a b c Luh, Tien-Yau; Kuo, Chi-Hong (ngày 1 tháng 1 năm 2001). Encychlorpedia of Reagents for Organic Synthesis (bằng tiếng Anh). John Wiley & Sons, Ltd. doi:10.1002/047084289X.rn009. ISBN 9780470842898.
- ^ Wakita, Hisanobu; Ichihashi, Mitsuyoshi; Mibuchi, Takeharu; Masuda, Isao (ngày 1 tháng 3 năm 1982). “The Structure of Nickel(II) Bromide in Highly Concentrated Aqueous Solution by X-Ray Diffraction Analysis”. Bulletin of the Chemical Society of Japan. 55 (3): 817–821. doi:10.1246/bcsj.55.817. ISSN 0009-2673.
- ^ DeFotis, G. C.; Goodey, J. R.; Narducci, A. A.; Welch, M. H. "NiBr2·3H2O, a lower dimensional antiferromagnet" Journal of Applied Physics (1996), 79(8, Pt. 2A), 4718-4720. doi:10.1063/1.361651
- ^ Konev, Mikhail O.; Hanna, Luke E.; Jarvo, Elizabeth R. (ngày 1 tháng 6 năm 2016). “Intra- and Intermolecular Nickel-Catalyzed Reductive Cross-Electrophile Coupling Reactions of Benzylic Esters with Aryl Halides”. Angewandte Chemie International Edition (bằng tiếng Anh). 55 (23): 6730–6733. doi:10.1002/anie.201601206. PMID 27099968.
- ^ Ueber ammoniakverbindungen der halogenide des zweiwertigen koba... (Bruno Fetkenheuer; 1914), trang 74. Truy cập 14 tháng 10 năm 2020.
- ^ https://www.chegg.com/homework-help/questions-and-answers/ni-nh3-4br2-solutions-complex-green-explain-s-green-terms-complexes-d-electrons-light-comp-q17483175[liên kết hỏng]
- ^ a b Thermal Decomposition of [Ni(N2H4)6]X2 Complexes. Truy cập 30 tháng 5 năm 2020.
- ^ Russian Journal of Physical Chemistry, Tập 47 (British Library Lending Division, 1973), trang 1519 – [1]. Truy cập 17 tháng 4 năm 2020.
- ^ Gmelin-Kraut's Handbuch der anorganischen chemie... unter mitwirkung hervorragender fachgenossen (Gmelin, Leopold, 1788-1853; Kraut, Karl Johann, 1829-1912), trang 1404 – [2]. Truy cập 30 tháng 5 năm 2020.
- ^ Abou-Melha, Khlood; Refat, Moamen S.; Elsabawy, Khaled M. (10 tháng 9 năm 2015). “Synthesis, structural visualization, spectroscopic, and thermal studies of charge transfer Cu(II), Ni(II) and Zn(II) bromides-carbamide complexes at elevated temperature”. Oriental Journal of Chemistry (bằng tiếng Anh). 31 (3): 1571–1586. doi:10.13005/ojc/310336.
- ^ Физико-химический анализ взаимодействия солей металлов с аллофанамидом, селегокарбомидом и карбамидом в водных растворах. Truy cập 31 tháng 5 năm 2020.
- ^ R. Sundararajan, M. Senthilkumar, C. Ramachandraraja — Growth and Characterization of Bisthiourea Nickel Bromide—New Semiorganic Nonlinear Optical Crystal. Journal of Crystallization Process and Technology, tập 3, № 2, 2013, tr. 56–59. doi:10.4236/jcpt.2013.32008.
- ^ Russian Journal of Inorganic Chemistry, Tập 5,Số phát hành 7-12 (The Chemical Society., 1960), trang 1322 – [3]. Truy cập 19 tháng 5 năm 2020.
- ^ Low Temperature Physics LT9: Proceedings of the IXth International Conference on Low Temperature Physics Columbus, Ohio, August 31 – ngày 4 tháng 9 năm 1964 (John Gilbert Daunt, International Union of Pure and Applied Physics; Springer, 16 thg 12, 2013 - 635 trang), trang 879. Truy cập 27 tháng 12 năm 2020.
- ^ Nickel: sect. 1-2. Coordination compounds with neutral and inner-complex-forming ligands (Verlag Chemie, 1969), trang 1014. Truy cập 5 tháng 3 năm 2021.
- ^ Sirota, A., & Šramko, T. (1974). Square planar NiII complexes of thiosemicarbazide. Inorganica Chimica Acta 8, 289–291. doi:10.1016/s0020-1693(00)92630-6.
- ^ Chemické Zvesti, Tập 30,Trang 1-408 (1976), trang 93. Truy cập 10 tháng 3 năm 2021.
- ^ Zhurnal neorganicheskoĭ khimii, Tập 14,Số phát hành 1-4 (Izd-vo "Nauka"., 1969), trang 982, 983, 985. Truy cập 29 tháng 12 năm 2020.
