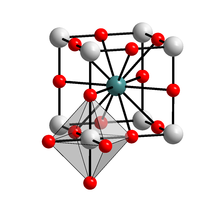
Kalia bismutato
Kalia bismutato estas neorganika kemiaĵo de kalio kaj bismuto , ruĝa solidaĵo, kiu estas forta oksidiganto kaj nesolvebla en varma akvo. Ĝi estas unu el la malmultaj kaliaj saloj kiuj estas nesolveblaj en akvo. Tamen, ĝi komerce disponeblas kaj ĝiaj specimenoj povas esti miksaĵo da bismuta (IV) oksido, kalia karbonato kaj kalia peroksido. Kalia bismutato estis unue studata de Martin Jansen.
Bismutaj kombinaĵoj estas uzataj en kosmetikaĵoj, pigmentoj, tinkturoj kaj farmaciaĵoj. Kelkaj bismutaj derivaĵoj estas uzataj en la traktado de la diareo .
Sintezoj
Oksidado de bismuta oksido en alkala medio:
Sintezo 1
2
B
i
2
O
3
+
2
K
2
O
2
+
O
2
→
450
−
600
o
C
4
K
B
i
O
3
{\displaystyle {\mathsf {2\;Bi_{2}O_{3}+2\;K_{2}O_{2}+O_{2}\ {\xrightarrow {450-600^{o}C}\ 4\;KBiO_{3}
Sintezo 2
B
i
2
O
3
+
2
K
2
O
2
+
2
K
O
H
→
400
−
500
o
C
{\displaystyle {\mathsf {Bi_{2}O_{3}+2\;K_{2}O_{2}+2\;KOH\ {\xrightarrow {400-500^{o}C}\ }
2
K
3
B
i
O
4
o
r
t
o
b
i
s
m
u
t
a
t
o
d
e
k
a
l
i
o
+
H
2
O
{\displaystyle {\mathsf {\underset {ortobismutato\;de\;kalio}{2\;K_{3}BiO_{4}+H_{2}O}
Sintezo 3
2
B
i
(
N
O
3
)
3
+
2
K
2
O
2
+
4
K
O
H
→
600
o
C
{\displaystyle {\mathsf {2\;Bi(NO_{3})_{3}+2\;K_{2}O_{2}+4\;KOH\ {\xrightarrow {600^{o}C}\ }
2
K
B
i
O
3
+
6
K
N
O
2
+
3
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {2\;KBiO_{3}+6\;KNO_{2}+3\;O_{2}\uparrow +2\;H_{2}O}
Sintezo 4
Bismutato de kalio same estiĝas per oksidigo de "bismuta hidroksido" kaj kalia hipoklorito en baza medio:
B
i
(
O
H
)
3
+
K
C
l
O
+
K
O
H
→
K
B
i
O
3
+
K
C
l
+
2
H
2
O
{\displaystyle {\mathsf {Bi(OH)_{3}+KClO+KOH\ {\xrightarrow {}\ KBiO_{3}+KCl+2\;H_{2}O}
Sintezo 5
B
i
2
O
3
+
6
K
O
H
+
2
B
r
2
→
2
K
B
i
O
3
+
4
K
B
r
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+6\;KOH+2\;Br_{2}\ {\xrightarrow {}\ 2\;KBiO_{3}+4\;KBr+3\;H_{2}O}
Reakcioj
Reakcio 1
Determinado de mangano en ŝtalo per bismutata metodo: Manganaj saloj oksidiĝas al permanganatoj per troo da kalia bismutato en la ĉeesto de nitrata acido [ 1]
M
n
+
K
B
i
O
3
+
4
H
N
O
3
→
K
M
n
O
4
+
B
i
(
N
O
3
)
2
+
3
N
O
+
2
H
2
O
{\displaystyle {\mathsf {Mn+KBiO_{3}+4\;HNO_{3}\ {\xrightarrow {}\ KMnO_{4}+Bi(NO_{3})_{2}+3\;NO+2\;H_{2}O}
Reakcio 2
K
B
i
O
3
+
6
H
C
l
→
0
o
C
K
[
B
i
C
l
4
]
+
C
l
2
↑
+
3
H
2
O
{\displaystyle {\mathsf {KBiO_{3}+6\;HCl\ {\xrightarrow {0^{o}C}\ K[BiCl_{4}]+Cl_{2}\uparrow +3H_{2}O}
Reakcio 3
2
K
B
i
O
3
+
2
H
N
O
3
+
(
n
−
1
)
H
2
O
→
0
o
C
B
i
2
O
5
⋅
n
H
2
O
+
2
K
N
O
3
{\displaystyle {\mathsf {2\,KBiO_{3}+2\;HNO_{3}+(n-1)H_{2}O\ {\xrightarrow {0^{o}C}\ Bi_{2}O_{5}\cdot nH_{2}O+2\;KNO_{3}
Reakcio 4
4
K
B
i
O
3
+
4
H
N
O
3
→
100
o
C
2
B
i
2
O
4
+
4
K
N
O
3
+
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {4\;KBiO_{3}+4\;HNO_{3}\ {\xrightarrow {100^{o}C}\ 2\;Bi_{2}O_{4}+4\;KNO_{3}+O_{2}\uparrow +2\;H_{2}O}
Reakcio 5
Ĝi malrapide reakcias kun alkaloj por estigi ortobismutaton:
K
B
i
O
3
+
2
K
O
H
→
100
o
C
K
3
B
i
O
4
o
r
t
o
−
b
i
s
m
u
t
a
t
o
d
e
k
a
l
i
o
+
H
2
O
{\displaystyle {\mathsf {KBiO_{3}+2\;KOH\ {\xrightarrow {100^{o}C}\ {\underset {orto-bismutato\,de\,kalio}{K_{3}BiO_{4}+H_{2}O}
Reakcio 6
K
B
i
O
3
+
2
H
2
O
→
100
o
C
4
K
O
H
+
2
B
i
2
O
3
+
3
O
2
{\displaystyle {\mathsf {KBiO_{3}+2\;H_{2}O\ {\xrightarrow {100^{o}C}\ 4\;KOH+2\;Bi_{2}O_{3}+3\;O_{2}
Reakcio 7
K
B
i
O
3
+
H
C
l
O
4
→
T
K
C
l
O
4
+
B
i
O
2
+
1
/
2
O
2
{\displaystyle {\mathsf {KBiO_{3}+HClO_{4}\ {\xrightarrow {T}\ KClO_{4}+BiO_{2}+1/2\;O_{2}
Literaturo
Referencoj
Neorganikaj saloj de kalio
The article is a derivative under the Creative Commons Attribution-ShareAlike License .
A link to the original article can be found here and attribution parties here
By using this site, you agree to the Terms of Use . Gpedia ® is a registered trademark of the Cyberajah Pty Ltd











![{\displaystyle {\mathsf {KBiO_{3}+6\;HCl\ {\xrightarrow {0^{o}C}\ K[BiCl_{4}]+Cl_{2}\uparrow +3H_{2}O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5947d98a49a13032441df593c40653702c8ffde7)





