Metal de transición
Los metales de transición son aquellos elementos químicos que están situados en la parte central del sistema periódico, en el constante bloque D, cuya principal característica es la inclusión en su configuración electrónica del orbital d, parcialmente lleno de electrones. Esta definición se puede ampliar considerando como elementos de transición a aquellos que poseen electrones alojados en el orbital d, esto incluiría a zinc, cadmio, y mercurio. La IUPAC define un metal de transición como "un elemento cuyo átomo tiene una subcapa d (subnivel de energía) incompleta o que puede dar lugar a cationes".[1]
Son metales de transición, ya que tienen una configuración d10. Solo se forman unas pocas especies transitorias de estos elementos que dan lugar a iones con una subcapa d parcialmente completa. Por ejemplo mercurio (I) solo se encuentra como Hg22+, el cual no forma un ion aislado con una subcapa parcialmente llena, por lo que los tres elementos son inconsistentes con la definición anterior.[2] Estos forman iones con estado de oxidación 2+, pero conservan la configuración 4d10. El elemento 112 podría también ser excluido aunque sus propiedades de oxidación no son observadas debido a su naturaleza radioactiva. Esta definición corresponde a los grupos 3 a 12 de la tabla periódica.
Según la definición más amplia los metales de transición son los cuarenta elementos químicos, del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112. El nombre de "transición" proviene de una característica que presentan estos elementos de poder ser estables por sí mismos sin necesidad de una reacción con otro elemento. Cuando a su última capa de valencia le faltan electrones para estar completa, los extrae de capas internas. Con eso es estable, pero le faltarían electrones en la capa donde los extrajo, así que los completa con otros electrones propios de otra capa. Y así sucesivamente; este fenómeno se le llama "Transición electrónica". Esto también tiene que ver con que estos elementos sean tan estables y difíciles de hacer reaccionar con otros. La definición más amplia es la que tradicionalmente se ha utilizado. Sin embargo muchas propiedades interesantes de los elementos de transición como grupo son el resultado de su subcapa d parcialmente completa. Las tendencias periódicas del bloque d son menos predominantes que en el resto de la tabla periódica. A través de esta la valencia no cambia porque los electrones adicionados al átomo van a capas internas.[3]
Definiciones
- La definición de la IUPAC[4] define un metal de transición como "un elemento cuyo átomo tiene una subcapa d parcialmente llena , o que puede dar lugar a cationes con una subcapa d incompleta ".
- Muchos científicos describen un "metal de transición" como cualquier elemento en el bloque d de la tabla periódica , que incluye los grupos 3 a 12 en la tabla periódica.[5][6] En la práctica real, las series de actínidos y lantánidos del bloque f también se consideran metales de transición y se denominan "metales de transición internos".
- Cotton y Wilkinson[7] amplían la breve definición de la IUPAC (véase más arriba) especificando qué elementos se incluyen. Además de los elementos de los grupos 4 a 11, añaden escandio e itrio en el grupo 3, que tienen una subcapa d parcialmente llena en estado metálico . El lantano y el actinio, que consideran elementos del grupo 3, se clasifican sin embargo como lantánidos y actínidos respectivamente.
- El químico inglés Charles Rugeley Bury (1890–1968) utilizó por primera vez la palabra transición en este contexto en 1921, cuando se refirió a una serie de transición de elementos durante el cambio de una capa interna de electrones (por ejemplo, n = 3 en la cuarta fila de electrones). la tabla periódica) de un grupo estable de 8 a uno de 18, o de 18 a 32.[8][9][10] Estos elementos ahora se conocen como el bloque d.
Elementos
| Grupo | 3 (III B) | 4 (IV B) | 5 (V B) | 6 (VI B) | 7 (VII B) | 8 (VIII B) | 9 (VIII B) | 10 (VIII B) | 11 (I B) | 12 (II B) |
|---|---|---|---|---|---|---|---|---|---|---|
| Periodo 4 | Sc 21 | Ti 22 | V 23 | Cr 24 | Mn 25 | Fe 26 | Co 27 | Ni 28 | Cu 29 | Zn 30 |
| Periodo 5 | Y 39 | Zr 40 | Nb 41 | Mo 42 | Tc 43 | Ru 44 | Rh 45 | Pd 46 | Ag 47 | Cd 48 |
| Periodo 6 | Lu 71 | Hf 72 | Ta 73 | W 74 | Re 75 | Os 76 | Ir 77 | Pt 78 | Au 79 | Hg 80 |
| Periodo 7 | Lr 103 | Rf 104 | Db 105 | Sg 106 | Bh 107 | Hs 108 | Mt 109 | Ds 110 | Rg 111 | Cn 112 |
Los elementos de los grupos 4 a 11 se reconocen generalmente como metales de transición, justificados por su química típica, es decir, una amplia gama de iones complejos en varios estados de oxidación, complejos coloreados y propiedades catalíticas como elemento o como iones (o ambos). Sc e Y en el grupo 3 también se reconocen generalmente como metales de transición. Sin embargo, los elementos La–Lu y Ac–Lr y el grupo 12 atraen diferentes definiciones de diferentes autores.
Muchos libros de texto de química y tablas periódicas impresas clasifican a La y Ac como elementos del grupo 3 y metales de transición, ya que sus configuraciones de estado fundamental atómico son s2d1 como Sc e Y. Los elementos Ce–Lu se consideran como la serie " lantánida " ( o "lantanoide" según la IUPAC) y Th–Lr como la serie " actínida ".[11][12] Las dos series juntas se clasifican como elementos de bloque f o (en fuentes más antiguas) como "elementos de transición interna". Sin embargo, esto da como resultado una división del bloque d en dos porciones bastante desiguales.[13]
Algunos libros de texto de química inorgánica incluyen «La» con los lantánidos y Ac con los actínidos.[7][14][15] Esta clasificación se basa en similitudes en el comportamiento químico (aunque esta similitud en su mayoría solo existe entre los lantánidos) y define 15 elementos en cada una de las dos series, aunque corresponden al relleno de un f subcapa, que solo puede contener 14 electrones.[16]
Una tercera clasificación define los elementos del bloque f como La–Yb y Ac–No, mientras que coloca a Lu y Lr en el grupo 3.[17] Esto se basa en el principio de Aufbau (o regla de Madelung) para llenar subcapas de electrones, en el cual 4f se llena antes que 5d (y 5f antes que 6d), de modo que la subcapa f está realmente llena en Yb (y No), mientras que Lu tiene una configuración [ ]s2f14d1. (Lr es una excepción donde el electrón d se reemplaza por un electrón p, pero la diferencia de energía es lo suficientemente pequeña como para que en un entorno químico a menudo muestre ocupación d de todos modos). La y Ac son, desde este punto de vista, simplemente considerados excepciones al principio de Aufbau con configuración electrónica [ ]s2f14d1 como predice el principio de Aufbau).[18] Los estados excitados del átomo libre y del ion pueden convertirse en el estado fundamental en entornos químicos, lo que justifica esta interpretación; La y Ac tienen subcapas bajas vacías f que se llenan en Lu y Lr, por lo que la excitación de los orbitales f es posible en La y Ac, pero no en Lu o Lr. Esto justifica la idea de que La y Ac simplemente tienen configuraciones irregulares (similares a Th as s 2 d 2 ), y que son el verdadero comienzo del bloque f.[19]
Como la tercera forma es la única forma que permite simultáneamente (1) la preservación de la secuencia de números atómicos crecientes, (2) un bloque f de 14 elementos de ancho y (3) evitar la división en el bloque d, ha sido sugerido por un informe preliminar de la IUPAC de 2021 como la forma preferida.[20] Los físicos soviéticos Lev Landau y Evgeny Lifshitz sugirieron por primera vez en 1948 esta modificación, que trata a Lu como un elemento de transición en lugar de como un elemento de transición interno.[21] Después de esto, fue sugerida por muchos otros físicos y químicos, y fue generalmente la clasificación adoptada por aquellos que consideraron el tema,[21] pero los libros de texto generalmente se retrasaron en adoptarla.[22]
El zinc , el cadmio y el mercurio a veces se excluyen de los metales de transición,[8] ya que tienen la configuración electrónica [ ]d10s2, sin capa d incompleta.[23] En el estado de oxidación +2, los iones tienen la configuración electrónica [ ]…d10. Aunque estos elementos pueden existir en otros estados de oxidación, incluido el estado de oxidación +1, como en el ion diatómico Hg2+
2, todavía tienen una capa d completa en estos estados de oxidación. Los elementos del grupo 12 Zn, Cd y Hg pueden, por lo tanto, bajo ciertos criterios, ser clasificados como metales de post-transición en este caso. Sin embargo, a menudo es conveniente incluir estos elementos en una discusión sobre los elementos de transición. Por ejemplo, cuando se analiza la energía de estabilización del campo cristalino de los elementos de transición de la primera fila, es conveniente incluir también los elementos calcio y zinc, ya que ambos Ca2+
y Zn2+
tienen un valor de cero, contra el cual se puede comparar el valor de otros iones de metales de transición. Otro ejemplo ocurre en la serie Irving-Williams de constantes de estabilidad de complejos.
La síntesis reciente (aunque discutida y hasta ahora no reproducida de forma independiente) de fluoruro de mercurio (IV) (HgF
4) ha sido tomado por algunos para reforzar la opinión de que los elementos del grupo 12 deben considerarse metales de transición,[24] pero algunos autores aún consideran que este compuesto es excepcional.[25] Se espera que Copernicium pueda usar sus electrones d para la química, ya que su subcapa 6d está desestabilizada por fuertes efectos relativistas debido a su número atómico muy alto y, como tal, se espera que tenga un comportamiento similar al de un metal de transición. cuando muestra estados de oxidación más altos que +2 (que no son definitivamente conocidos para los elementos más ligeros del grupo 12).
Aunque el meitnerio, el darmstadtio y el roentgenio se encuentran dentro del bloque d y se espera que se comporten como metales de transición de manera análoga a sus congéneres más ligeros como el iridio, el platino y el oro, esto aún no se ha confirmado experimentalmente. No está claro si el copernicio se comporta más como el mercurio o tiene propiedades más similares a las del gas noble radón.
Propiedades
Casi todos los elementos son metales típicos, de elevada dureza, con puntos de fusión y ebullición altos, buenos conductores tanto del calor como de la electricidad. Muchas de las propiedades de los metales de transición se deben a la capacidad de los electrones del orbital d de localizarse dentro de la red metálica. En metales, cuantos más electrones compartan un núcleo, más fuerte es el metal. Poseen una gran versatilidad de estados de oxidación, pudiendo alcanzar una carga positiva tan alta como la de su grupo, e incluso en ocasiones negativa (Como en algunos complejos de coordinación).
- Sus combinaciones son fuertemente coloreadas y paramagnéticas.
- Sus potenciales normales suelen ser menos negativos que el de los metales representativos, estando entre ellos los llamados metales nobles.
- Pueden formar aleaciones entre ellos.
- Son en general buenos catalizadores.
- Son sólidos a temperatura ambiente (excepto el mercurio)
- Forman complejos iónicos.
Estados de oxidación variables
A diferencia de los metales de los grupos 1 y 2, los iones de los elementos de transición pueden tener múltiples estados de oxidación estables ya que pueden perder electrones d sin un gran sacrificio energético. El manganeso, por ejemplo tiene dos electrones 4s y cinco 3d que pueden ser eliminados. La pérdida de todos estos electrones lleva a un estado de oxidación +7. El osmio y el rutenio se encuentran comúnmente solos en un estado de oxidación +8 muy estable el cual es uno de los más elevados para compuestos aislados.
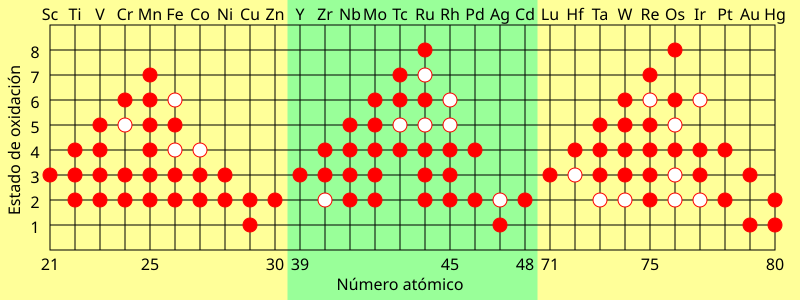
Un círculo lleno representa el estado de oxidación común, un anillo de centro blanco representa uno menos común (menos favorable energéticamente).
Ciertos patrones en los estados de oxidación surgen a través de los periodos de los elementos de transición:
- El número de estados de oxidación aumenta para cada ion hasta el Mn, a partir del cual comienza a disminuir. Los últimos metales de transición tienen una mayor atracción entre protones y electrones (ya que hay más de cada uno presentes), lo que requeriría más energía para eliminar los electrones.
- Cuando los elementos están en estados de oxidación bajos, se pueden encontrar como iones simples. Sin embargo, los metales de transición en estados de oxidación elevados se encuentran generalmente unidos covalentemente a elementos electronegativos como oxígeno o flúor formando iones poliatómicos como el cromato, vanadato, o permanganato.
Otras propiedades con respecto a la estabilidad de los estados de oxidación:
- Iones en elevados estados de oxidación tienden a ser buenos agentes oxidantes, mientras que elementos en bajos estados de oxidación tienden a ser buenos agentes reductores.
- Iones 2+ a través del periodo comienzan como fuertes reductores y se vuelven más estables.
- Iones 3+ comienzan estables y se vuelven más oxidantes a través del periodo.
Actividad catalítica
Los metales de transición forman buenos catalizadores homogéneos y heterogéneos, por ejemplo el hierro es el catalizador para el proceso de Haber y tanto el níquel como el platino son utilizados para la hidrogenación de alquenos. Esto es porque son capaces de reaccionar bajo numerosos estados de oxidación y como consecuencia de ello formar nuevos compuestos proveyendo una ruta de reacción alternativa con una energía de activación más baja.
Compuestos coloreados

Debido a su estructura, los metales de transición forman muchos iones y complejos coloreados. Los colores pueden cambiar entre diferentes iones de un mismo elemento. Por ejemplo el MnO4− (Mn en el estado de oxidación 7+) es un compuesto violeta, mientras que Mn2+ es rosado pálido.
La coordinación por ligandos puede jugar su parte en determinar el color en un compuesto de transición debido a cambios en la energía de los orbitales d. Los ligandos eliminan la degeneración de los orbitales y los dividen en grupos de alta y baja energía. La diferencia de energía entre los orbitales de alta y baja energía determinará el color de la luz que es absorbida, ya que la radiación electromagnética se absorbe si tiene una energía que se corresponda con esta diferencia. Cuando un ion con ligandos absorbe luz algunos electrones son promovidos a un orbital de mayor energía. Si la luz absorbida es de diferente frecuencia, se observan diferentes colores.
El color de un complejo depende de:
- la naturaleza del ion metálico, particularmente el número de electrones en los orbitales d
- el orden de los ligandos alrededor del ion metálico (por ejemplo, diferentes isómeros geométricos pueden mostrar diferentes colores)
- la naturaleza de los ligandos rodeando al ion metálico. Si los ligandos son más fuertes, es mayor la diferencia de energía entre los grupos 3d.
El complejo formado por el elemento zinc del bloque d (aunque no es estrictamente un elemento de transición) es incoloro, porque los orbitales 3d están completos y los electrones no son capaces de desplazarse al grupo superior.
Véase también
- Elementos del bloque d
- Tabla periódica de los elementos
- Elemento representativo
- Teoría del campo de los ligantes
- Teoría del campo cristalino
- Metal del bloque p
Referencias
- ↑ transition element, IUPAC Compendium of Chemical Terminology
- ↑ Cotton, F. Albert; Wilkinson, G.; Murillo, C. A. (1999). Advanced Inorganic Chemistry (6th ed.). New York: Wiley. ISBN 0-471-19957-5
- ↑ Matsumoto, Paul S. Trends in Ionization Energy of Transition-Metal Elements Archivado el 8 de julio de 2007 en Wayback Machine. J. Chem. Educ. 2005 82, 1660.
- ↑ Unión Internacional de Química Pura y Aplicada. «transition element». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General chemistry: principles and modern applications (8th edición). Upper Saddle River, N.J: Prentice Hall. pp. 341–342. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
- ↑ Housecroft, C. E. and Sharpe, A. G. (2005) Inorganic Chemistry, 2nd ed, Pearson Prentice-Hall, pp. 20–21.
- ↑ a b Cotton, F. A. and Wilkinson, G. (1988) Inorganic Chemistry, 5th ed., Wiley, pp. 625–627. ISBN 978-0-471-84997-1.
- ↑ a b Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education 80 (8): 952-961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952.
- ↑ Bury, C. R. (1921). «Langmuir's theory of the arrangement of electrons in atoms and molecules». J. Am. Chem. Soc. 43 (7): 1602-1609. doi:10.1021/ja01440a023.
- ↑ Bury, Charles Rugeley. Encyclopedia.com Complete dictionary of scientific biography (2008).
- ↑ Petrucci, Harwood y Herring, 2002, pp. 49–50, 951.
- ↑ Miessler, G. L. and Tarr, D. A. (1999) Inorganic Chemistry, 2nd edn, Prentice-Hall, p. 16. ISBN 978-0-13-841891-5.
- ↑ Scerri, Eric (2009). «Which Elements Belong in Group 3?». Journal of Chemical Education 86 (10): 1188. Bibcode:2009JChEd..86.1188S. doi:10.1021/ed086p1188.
- ↑ Plantilla:Greenwood&Earnshaw
- ↑ Housecroft, C. E. and Sharpe, A. G. (2005) Inorganic Chemistry, 2nd ed., Pearson Prentice-Hall, p. 741.
- ↑ Scerri, Eric (18 de enero de 2021). «Provisional Report on Discussions on Group 3 of the Periodic Table». Chemistry International 43 (1): 31-34. S2CID 231694898. doi:10.1515/ci-2021-0115.
- ↑ William B. Jensen (1982). «The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table». J. Chem. Educ. 59 (8): 634-636. Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634.
- ↑ Scerri, E. R. (2011) A Very Short Introduction to the Periodic Table, Oxford University Press.
- ↑ Jensen, W. B. (2015). «Some Comments on the Position of Lawrencium in the Periodic Table». Archivado desde el original el 23 de diciembre de 2015. Consultado el 20 de septiembre de 2015.
- ↑ L. D. Landau, E. M. Lifshitz (1958). Quantum Mechanics: Non-Relativistic Theory. Vol. 3 (1st edición). Pergamon Press. pp. 256-7.
- ↑ a b Jensen, William B. (2015). «The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update». Foundations of Chemistry 17: 23-31. S2CID 98624395. doi:10.1007/s10698-015-9216-1. Consultado el 28 de enero de 2021.
- ↑ «The constitution of group 3 of the periodic table». IUPAC. 2015. Archivado desde el original el 5 de julio de 2016. Consultado el 30 de julio de 2016.
- ↑ Cotton, F. Albert; Wilkinson, G.; Murillo, C. A. (1999). Advanced Inorganic Chemistry (6th ed.). New York: Wiley, ISBN 978-0-471-19957-1.
- ↑ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin (2007). «Mercury Is a Transition Metal: The First Experimental Evidence for HgF4». Angew. Chem. Int. Ed. 46 (44): 8371-8375. PMID 17899620. doi:10.1002/anie.200703710.
- ↑ Jensen, William B. (2008). «Is Mercury Now a Transition Element?». J. Chem. Educ. 85 (9): 1182-1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre metal de transición.
Wikcionario tiene definiciones y otra información sobre metal de transición.