Fluoruro di triazoto
| Fluoruro di triazoto | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| fluoruro di triazoto | |
| Nomi alternativi | |
| fluoruro di triazadienile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | FN3 |
| Aspetto | gas giallo-verde[1] |
| Numero CAS | |
| PubChem | 23235952 |
| SMILES | [N-]=[N+]=NF |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,698 |
| Temperatura di fusione | −154 °C (119 K)[1] |
| Temperatura di ebollizione | −82 °C (191 K)[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 344[1] |
| Indicazioni di sicurezza | |
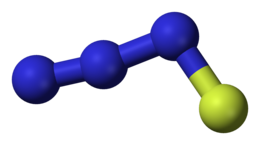
Il fluoruro di triazoto o fluoruro di triazadienile è il composto inorganico con formula N3F, a volte scritta come FN3. In condizioni normali è un gas di colore giallo-verde fortemente reattivo ed esplosivo.[1]
Nomenclatura
In base alle regole IUPAC[2] la formula del composto può essere indifferentemente scritta come N3F o come FN3. Nel primo caso gli elementi sono riportati in ordine di elettronegatività crescente (come NaF), nel secondo caso in ordine alfabetico. Per quanto riguarda il nome del composto, va considerato che il fluoro è l'elemento più elettronegativo, e quindi nel composto il gruppo N3 è polarizzato positivamente. La denominazione azoturo di fluoro, talvolta usata nella letteratura scientifica, è impropria dato che in chimica inorganica il termine azoturo indica uno ione N−3.
Struttura molecolare
La molecola N3F è caratterizzata da una sequenza di atomi N-N-N-F, dove il frammento N-N-N è sostanzialmente lineare, l'angolo N-N-F è circa 102° e la distanza N-F 144 pm.[1] La simmetria risulta Cs.[3]
Sintesi
Il fluoruro di triazoto fu ottenuto per la prima volta da J. F. Haller nel 1942 facendo reagire in fase gassosa acido azotidrico e fluoro. La reazione è potenzialmente esplosiva.[1][4]
Alternativamente si può preparare con la reazione tra azoturo di sodio e fluoro.[5]
Reattività
A temperatura ambiente N3F si decompone lentamente formando difluoruro di diazoto e azoto:[1]
Alla temperatura di circa 1000K N3F si frammenta formando il radicale metastabile NF:[5]
In fase gassosa a temperatura ambiente non reagisce con H2O, O2, XeF2, OF2, e Me3SiN3. Reagisce invece con NO, CO e COS; i prodotti formati indicano che un possibile intermedio è il radicale NF(a1Δ):[4]
Riscaldando a 120 ºC una miscela di N3F e N3Cl si ottiene una sostanza gialla, fortemente esplosiva, non isolata, che ha probabilmente formula ClNNF.[3]
Note
Bibliografia
- (EN) D. J. Benard, B. K. Winker, T. A. Seder e R. H. Cohn, Production of nitrogen monofluoride (a1Δ) by dissociation of fluorine azide, in J. Phys. Chem., vol. 93, n. 12, 1989, pp. 4790–4796, DOI:10.1021/j100349a022.
- (EN) N. G. Connelly, T. Damhus, R. M. Hartshorn e A. T. Hutton (a cura di), Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005 (PDF), Cambridge, UK, RCS Publishing, 2005, ISBN 0-85404-438-8.
- (EN) K. Gholivand, G. Schatte e H. Willner, Properties of triazadienyl fluoride, N3F, in Inorg. Chem., vol. 26, n. 13, 1987, pp. 2137–2140, DOI:10.1021/ic00260a025.
- (EN) A. Hammerl e T. M. Klapötke, Nitrogen: Inorganic Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia157, ISBN 9780470862100.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
Altri progetti
 Wikimedia Commons contiene immagini o altri file su fluoruro di triazoto
Wikimedia Commons contiene immagini o altri file su fluoruro di triazoto



![{\displaystyle {\ce {N3F -> [NF] + N2 -> N2F2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a435af7f4f187bdb8db9e5166cbb2b96d1245571)

![{\displaystyle {\ce {N3F + CO -> [FNCO] + N2 -> FC(O)NCO}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38c34667d5d5d4c48ae56a4fd2e10e8cdb78a02c)
