నియాన్
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Appearance | colorless gas exhibiting an orange-red glow when placed in an electric field | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ne) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Neon in the periodic table | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | మూస:Infobox element/symbol-to-group/format | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [He] 2s2 2p6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 24.56 K (−248.59 °C, −415.46 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 27.104 K (−246.046 °C, −410.883 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 0.9002 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 1.207 g/cm3[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Triple point | 24.556 K, 43.37 kPa[4][5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 44.4918 K, 2.7686 MPa[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 0.335 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 1.71 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 20.79[6] J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 58 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 154 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound | 435 m/s (gas, at 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 49.1×10−3 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | diamagnetic[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | −6.74×10−6 cm3/mol (298 K)[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 654 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-01-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prediction | William Ramsay (1897) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | William Ramsay & Morris Travers[9][10] (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes of neon | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Template:infobox neon isotopes does not exist | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
నియాన్ Ne రసాయనిక చిహ్నంతో, పరమాణు సంఖ్య 10 కలిగిన రసాయన మూలకం. ఇది ఒక ఉత్కృష్ట వాయువు. [11] ఇది ప్రామాణిక పరిస్థితుల్లో రంగులేని, వాసన లేని, జడ మోనో అటామిక్ వాయువు. నియాన్ సాంద్రత గాలి సాంద్రతలో మూడింట రెండు వంతులు ఉంటుంది. పొడి గాలిలో నత్రజని, ఆక్సిజన్, ఆర్గాన్, కార్బన్ డయాక్సైడ్ లను తీసేస్తే ఆ తర్వాత మిగిలి ఉండే మూడు అరుదైన జడ మూలకాలలో (క్రిప్టాన్, జినాన్లతో పాటు) నియాన్ ఒకటి 1898లో కనుగొన్నారు. ఈ మూడు అరుదైన వాయువులలో నియాన్ రెండవది, దాని ప్రకాశవంతమైన ఎరుపు ఉద్గార స్పెక్ట్రంను బట్టి వెంటనే దీన్ని కొత్త మూలకం అని గుర్తించారు. నియాన్ అనే పేరు గ్రీకు పదం నియోస్ నుండి వచ్చింది నియోస్ అంటే 'కొత్త' అని అర్థం. నియాన్ రసాయనికంగా జడమైనది, ఛార్జ్ చేయని నియాన్ సమ్మేళనాలు లేవు. ప్రస్తుతం తెలిసిన నియాన్ సమ్మేళనాలు అయానిక్ అణువులు, వాన్ డెర్ వాల్స్ శక్తులు, క్లాత్రేట్లచే కలిసి ఉంచబడిన అణువులు.
నక్షత్రాల్లో మూలకాల న్యూక్లియోజెనిసిస్ సమయంలో, ఆల్ఫా-క్యాప్చర్ ఫ్యూజన్ ప్రక్రియ నుండి పెద్ద మొత్తంలో నియాన్ ఏర్పడుతుంది. విశ్వంలో, సౌర వ్యవస్థలో నియాన్ చాలా సాధారణ మూలకం అయినప్పటికీ (విశ్వంలో ఇది హైడ్రోజన్, హీలియం, ఆక్సిజన్, కార్బన్ ల తర్వాత సమృద్ధిలో ఐదవది), ఇది భూమిపై చాలా అరుదు. ఘనపరిమాణాన్ని బట్టి గాలిలో ఇది దాదాపు 18.2 ppm ఉంటుంది. భూమి పైపెంకులో ఒక చాలా కొద్దిపాటి భాగం. భూమిపైన, అంతర్గత (భూగోళ) గ్రహాలపైనా నియాన్ తక్కువగా ఉండడానికి కారణం ఏమిటంటే, నియాన్ చాలా వోలటైల్గా ఉండడం, అది ఇతర పదార్థాలతో సమ్మేళనాలను ఏర్పరచదు. ఫలితంగా, ఇది సౌర వ్యవస్థ ప్రారంభంలో కొత్తగా ఏర్పడిన సూర్యుని వెచ్చదనం కింద, ఆదిమ గ్రహాల నుండి తప్పించుకుంది. బృహస్పతి యొక్క బయటి వాతావరణంలో కూడా నియాన్ పరిమాణం కొంతవరకు క్షీణించింది. అయితే దానికి కారణం వేరే ఉంది. [12]
తక్కువ- వోల్టేజ్ నియాన్ దీపాల్లో, హై-వోల్టేజ్ డిశ్చార్జ్ ట్యూబ్లు, నియాన్ అడ్వర్టైజింగ్ చిహ్నాలలో ఉపయోగించినప్పుడు నియాన్ ఒక ప్రత్యేకమైన ఎరుపు-నారింజ వెలుతురును ఇస్తుంది. [13] [14] నియాన్ నుండి వెలువడే ఎరుపు ఉద్గార రేఖ హీలియం-నియాన్ లేజర్ల యొక్క బాగా తెలిసిన ఎరుపు కాంతికి కూడా కారణమవుతుంది. నియాన్ను కొన్ని ప్లాస్మా ట్యూబ్లు, రిఫ్రిజెరాంట్లలో కూడా వాడతారు. కొన్ని ఇతర వాణిజ్య ఉపయోగాలు కూడా ఉన్నాయి. ఇది ద్రవీకృత గాలి యొక్క ఆంశిక స్వేదనం ద్వారా వాణిజ్యపరంగా సంగ్రహిస్తారు. గాలి ఒక్కటే దానికి వనరు కాబట్టి, నియాన్ హీలియం కంటే చాలా ఖరీదైనది.
చరిత్ర

నియాన్ను 1898లో బ్రిటిష్ రసాయన శాస్త్రవేత్తలు సర్ విలియం రామ్సే (1852–1916), మోరిస్ ట్రావర్స్ (1872–1961) లు లండన్లో కనుగొన్నారు. [15] రామ్సే గాలిని ద్రవంగా మారే వరకు చల్లబరిచి, ఆ తరువాత ఆ ద్రవాన్ని వేడి చేసి, వాయువులు మరుగుతూండగా వివిధ వాయువులను సంగ్రహించాడు. నైట్రోజన్, ఆక్సిజన్, ఆర్గాన్ వాయువులను గుర్తించాడు. అయితే మిగిలిన వాయువులను ఆరు వారాల వ్యవధిలో 1898 మే చివరిలో వేరుచేసాడు. ముందుగా గుర్తించినది క్రిప్టాన్. క్రిప్టాన్ను తొలగించిన తర్వాత, స్పెక్ట్రోస్కోపిక్ డిశ్చార్జిలో అద్భుతమైన ఎరుపు కాంతిని ఇచ్చే వాయువు కనిపించింది. జూన్లో గుర్తించిన ఈ వాయువుకు "నియాన్" అని పేరు పెట్టాడు. ఇది రామ్సే కుమారుడు సూచించిన లాటిన్ నోవమ్ ('కొత్త') [16] కు గ్రీకు పేరు. ఎలక్ట్రికల్గా ఉత్తేజితమైనప్పుడు నియాన్ వాయువు విడుదల చేసే మెరిసే ఎరుపు-నారింజ రంగును వెంటనే గుర్తించాడు. ట్రావర్స్ తరువాత ఇలా వ్రాశాడు: "ట్యూబ్ నుండి వచ్చే క్రిమ్సన్ లైట్ దాని కథను చెప్పుకుంది. ఇది ఎప్పటికీ మరచిపోలేని దృశ్యం." [17]
1913లో అణువుల స్వభావంపై ప్రాథమిక అవగాహనలో నియాన్ పాత్ర పోషించింది. 1913లో JJ థామ్సన్, కెనాల్ కిరణాల కూర్పు గురించి చేస్తున్న అన్వేషణలో భాగంగా, ఒక అయస్కాంత, విద్యుత్ క్షేత్రం ద్వారా నియాన్ అయాన్ల ప్రవాహాలను ప్రసారం చేసి, దాని విక్షేపాన్ని ఫోటోగ్రాఫిక్ ప్లేట్తో కొలిచాడు. థామ్సన్ ఫోటోగ్రాఫిక్ ప్లేట్పై రెండు వేర్వేరు కాంతి క్షేత్రాలను గమనించాడు. ఇది విక్షేపం యొక్క రెండు వేర్వేరు పారాబొలాలను సూచించింది. నియాన్ వాయువులోని కొన్ని పరమాణువులు మిగిలిన వాటి కంటే ఎక్కువ ద్రవ్యరాశిని కలిగి ఉన్నాయని థామ్సన్ చివరికి నిర్ధారించాడు. థామ్సన్కు ఆ సమయంలో అర్థం కానప్పటికీ, స్థిరమైన పరమాణువుల ఐసోటోపులను గుర్తించిన తొలి ఆవిష్కరణ అది. థామ్సన్ పరికరం అనేది ఇప్పుడు మనం మాస్ స్పెక్ట్రోమీటర్ అని పిలుస్తున్న పరికరానికి ముడి వెర్షన్.
ఐసోటోపులు
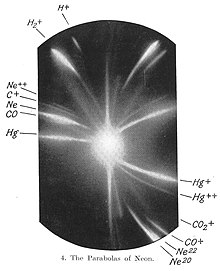
నియాన్కు మూడు స్థిరమైన ఐసోటోప్లున్నాయి. అవి: 20Ne (90.48%), 21Ne (0.27%), 22Ne (9.25%).
21Ne, 22Ne లు పాక్షికంగా ఆదిమ కాలంలో తయారైనవి కాగా, పాక్షికంగా న్యూక్లియోజెనిక్ (అంటే న్యూట్రాన్లు లేదా పర్యావరణంలోని ఇతర కణాలతో ఇతర న్యూక్లైడ్ల అణు ప్రతిచర్యల ద్వారా తయారు చేయబడినవి). ప్రాకృతికంగా వాటి సమృద్ధి గురించి బాగా అర్థం తెలుసు. దీనికి విరుద్ధంగా, 20Ne (నక్షత్ర న్యూక్లియోసింథసిస్లో తయారైన ప్రధాన ఆదిమ ఐసోటోప్) న్యూక్లియోజెనిక్ లేదా రేడియోజెనిక్ అనేది తెలియదు. భూమిలో 20Ne యొక్క వైవిధ్యానికి గల కారణాలు చర్చనీయాంశంగా ఉన్నాయి. [18] [19]
లభ్యత

నియాన్ యొక్క స్థిరమైన ఐసోటోప్లు నక్షత్రాలలో ఉత్పత్తి అవుతాయి. అత్యంత సమృద్ధిగా ఉన్న నియాన్ ఐసోటోప్ 20Ne (90.48%) నక్షత్రాల్లో జరిగే న్యూక్లియోసింథసిస్ లో భాగంగా జరిగే కార్బన్-బర్నింగ్ ప్రక్రియలో కార్బన్, కార్బన్ ల అణు కలయిక ద్వారా సృష్టించబడుతుంది. దీనికి 500 మెగాకెల్విన్ల కంటే ఎక్కువ ఉష్ణోగ్రతలు అవసరం. ఇంత ఉష్ణోగ్రత, 8 కంటే ఎక్కువ సౌర ద్రవ్యరాశి ఉన్న నక్షత్రాల కోర్లలో ఉంటుంది. [20] [21]
విశ్వ స్థాయిలో నియాన్ సమృద్ధిగా ఉంటుంది; ఇది హైడ్రోజన్, హీలియం, ఆక్సిజన్, కార్బన్ ల తర్వాత ద్రవ్యరాశి ప్రకారం విశ్వంలో ఐదవ అత్యంత సమృద్ధిగా ఉన్న రసాయన మూలకం. [22] హీలియం లాగా భూమిపై ఇది అరుదుగా లభిస్తుంది. సాపేక్షికంగా తేలికగా ఉండడం, చాలా తక్కువ ఉష్ణోగ్రతల వద్ద అధిక ఆవిరి పీడనం, రసాయన జడత్వం వంటి లక్షణాల కారణంగా ఘనీభవించిన వాయువు, ధూళి మేఘాలలో చిక్కుకోకుండా భూమి వంటి చిన్న, వెచ్చని ఘన గ్రహాలలో తక్కువ పరిమాణాల్లో ఉంది. నియాన్ మోనోఅటామిక్ మూలకం. ఇది భూమి వాతావరణంలో ఎక్కువ భాగం ఉన్న డయాటోమిక్ నైట్రోజన్, ఆక్సిజన్ అణువుల కంటే తేలికగా ఉంటుంది; నియాన్తో నిండిన బెలూన్ గాలిలో పైకి లేస్తుంది, అయితే హీలియం బెలూన్ కంటే ఇది నెమ్మదిగా ఉంటుంది. [23]
విశ్వంలో నియాన్ సమృద్ధి 750లో 1 వంతు ఉంటుంది; సూర్యునిలో, బహుశా ప్రోటో-సౌర వ్యవస్థ నెబ్యులాలో, 600లో 1 భాగం ఉంటుంది. గెలీలియో స్పేస్క్రాఫ్ట్ అట్మాస్ఫియరిక్ ఎంట్రీ ప్రోబ్, బృహస్పతి యొక్క ఎగువ వాతావరణంలో కూడా, నియాన్ యొక్క సమృద్ధి పదో వంతుకు క్షీణించిందని, ద్రవ్యరాశి ప్రకారం 6,000లో 1 భాగానికి చేరుకుందనీ తెలిపింది. బాహ్య సౌర వ్యవస్థ నుండి బృహస్పతిలోకి నియాన్ను తీసుకువచ్చిన మంచు గ్రహాలు కూడా నియాన్ను నిలుపుకోలేని వెచ్చటి ప్రాంతంలో ఏర్పడ్డాయని ఇది సూచిస్తుంది (బృహస్పతిపై భారీ జడ వాయువుల సమృద్ధి సూర్యునిలో ఉన్నదాని కంటే చాలా రెట్లు ఎక్కువ. ). [24]
భూమి వాతావరణంలో నియాన్ 55,000లో 1 భాగం - అంటే ఘనపరిమాణం ప్రకారం 18.2 ppm - గాలిలో ద్రవ్యరాశి ప్రకారం 79,000 లలో 1 భాగం ఉంటుంది. భూమి పైపెంకులో చాలా స్వల్ప భాగం ఉంటుంది. ద్రవీకృత గాలిని క్రయోజెనిక్ ఆంశిక స్వేదనం ద్వారా పారిశ్రామికంగా నియాన్ను ఉత్పత్తి చేస్తారు.
2015 ఆగస్టు 17 న, లూనార్ అట్మాస్పియర్ అండ్ డస్ట్ ఎన్విరాన్మెంట్ ఎక్స్ప్లోరర్ (LADEE) అంతరిక్ష నౌకతో చేసిన అధ్యయనాల ఆధారంగా, NASA శాస్త్రవేత్తలు చంద్రుని బాహ్యగోళంలో నియాన్ను గుర్తించినట్లు నివేదించారు. [25]
రసాయనికం
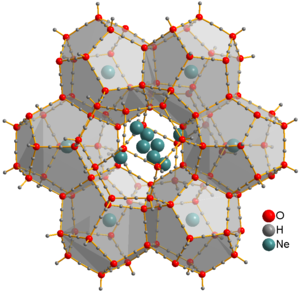
నియాన్ p-బ్లాక్ లో ఉండే మొదటి ఉత్కృష్ట వాయువు. ఎలక్ట్రాన్ల ఆక్టెట్ కలిగిన మొదటి మూలకం. ఆప్టికల్, మాస్ స్పెక్ట్రోమెట్రిక్ అధ్యయనాల ద్వారా అయాన్లు [Ne Ar ] +, [Ne H ] + లను [HeNe] + నూ గమనించారు. ఘన నియాన్ క్లాత్రేట్ హైడ్రేట్ను నీటి మంచు, నియాన్ వాయువు నుండి 350-480 MPa పీడనం, -30 °C ఉష్ణోగ్రతలు వద్ద ఉత్పత్తి చేసారు. [27] Ne అణువులు నీటికి బంధించబడక, స్వేచ్ఛగా కదలగలవు. క్లాత్రేట్ను చాలా రోజుల పాటు వాక్యూమ్ చాంబర్లో ఉంచి, వాటిని సంగ్రహించవచ్చు, ఇది నీటి యొక్క అతి తక్కువ దట్టమైన స్ఫటికాకార రూపాన్ని (ఐస్ XVI) ఇస్తుంది. [28]
ఉత్పత్తి
క్రయోజెనిక్ ఎయిర్-సెపరేషన్ ప్లాంట్లలో గాలి నుండి నియాన్ ఉత్పత్తి అవుతుంది. ప్రధానంగా నైట్రోజన్, నియాన్, హీలియం ల వాయు మిశ్రమాన్ని అధిక-పీడన విభజన గొట్టానికి ఎగువన ఉన్న ప్రధాన కండెన్సర్ నుండి బయటికి పంపించేసి, నియాన్ ను పక్కన ఉన్న వేరే గొట్టం లోకి పంపిస్తారు. [29] దాన్ని హీలియం నుండి విడదీసి, మరింత శుద్ధి చేస్తారు.
ప్రపంచ నియాన్ సరఫరాలో దాదాపు 70% ఉక్రెయిన్లో ఉత్పత్తి అవుతోంది. [30] రష్యాలో ఉక్కు ఉత్పత్తిలో ఉప ఉత్పత్తిగా తయారవుతోంది. [31] 2020 నాటికి, Iceblick కంపెనీ తన ఒడెస్సా, మాస్కో ప్లాంట్లతో, ప్రపంచంలోని నియాన్ ఉత్పత్తిలో 65 శాతం, అలాగే క్రిప్టాన్, జినాన్లలో 15% సరఫరా చేస్తుంది. [32] [33]
అప్లికేషన్లు
నియాన్ తరచుగా పేరు ఫలకాల్లో ఉపయోగిస్తారు. స్పష్టమైన ఎరుపు-నారింజ కాంతిని ఉత్పత్తి చేస్తుంది. ఇతర రంగులతో కూడిన ట్యూబ్ లైట్లు తరచుగా "నియాన్" అని పిలువబడుతున్నప్పటికీ, అవి వివిధ ఉత్కృష్ట వాయువులు లేదా ఫ్లోరోసెంట్ లైటింగ్ లోని వివిధ రంగులను ఉపయోగిస్తాయి.
నియాన్ను వాక్యూమ్ ట్యూబ్లు, హై-వోల్టేజ్ ఇండికేటర్లు, లైట్నింగ్ అరెస్టర్లు, వేవ్మీటర్ ట్యూబ్లు, టెలివిజన్ ట్యూబ్లు, హీలియం-నియాన్ లేజర్లలో ఉపయోగిస్తారు. ద్రవీకృత నియాన్ను వాణిజ్యపరంగా క్రయోజెనిక్ రిఫ్రిజెరాంట్గా ఉపయోగిస్తారు. మరింత తీవ్రమైన ద్రవ-హీలియం ను వాడి బాగా తక్కువ ఉష్ణోగ్రతలను సాధించాల్సిన అవసరం లేణిచోట్ల నియాన్ను వాడతారు.
నియాన్, ద్రవ రూపంలో గానీ వాయు రూపంలో గానీ, చిన్న పరిమాణాల్లో చాలా ఖరీదైనది. ద్రవ నియాన్ ధర ద్రవ హీలియం కంటే 55 రెట్లు ఎక్కువగా ఉంటుంది. నియాన్ ప్రియంగా ఉండడానికి కారణం అది అరుదైనది కావడం, హీలియం లాగా కాకుండా, వాతావరణం నుండి ఫిల్టర్ చేయడం ద్వారా మాత్రమే దీన్ని తగు పరిమాణంలో పొందవచ్చు.
మూలాలు
- ↑ "Standard Atomic Weights: Neon". CIAAW. 1985.
- ↑ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry (in ఇంగ్లీష్). doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ↑ Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics 81st edition (PDF). CRC press. p. 19. ISBN 0849304814.
- ↑ Preston-Thomas, H. (1990). "The International Temperature Scale of 1990 (ITS-90)". Metrologia. 27 (1): 3–10. Bibcode:1990Metro..27....3P. doi:10.1088/0026-1394/27/1/002.
- ↑ 5.0 5.1 Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.122. ISBN 1439855110.
- ↑ Shuen-Chen Hwang, Robert D. Lein, Daniel A. Morgan (2005). "Noble Gases". in Kirk Othmer Encyclopedia of Chemical Technology, pages 343–383. Wiley. doi:10.1002/0471238961.0701190508230114.a01.pub2
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ↑ Ramsay, William; Travers, Morris W. (1898). "On the Companions of Argon". Proceedings of the Royal Society of London. 63 (1): 437–440. doi:10.1098/rspl.1898.0057.
- ↑ "Neon: History". Softciências. Retrieved 2007-02-27.
- ↑ Group 18 refers to the modern numbering of the periodic table.
- ↑ Wilson, Hugh F.; Militzer, Burkhard (March 2010), "Sequestration of Noble Gases in Giant Planet Interiors", Physical Review Letters, vol. 104, no. 12, p. 121101, arXiv:1003.5940, Bibcode:2010PhRvL.104l1101W, doi:10.1103/PhysRevLett.104.121101, PMID 20366523, 121101.
- ↑ Coyle, Harold P. (2001). Project STAR: The Universe in Your Hands. Kendall Hunt. p. 464. ISBN 978-0-7872-6763-6.
- ↑ Kohmoto, Kohtaro (1999). Phosphor Handbook. CRC Press. p. 940. ISBN 978-0-8493-7560-6.
- ↑ . "On the Companions of Argon".
- ↑ "Neon: History". Softciências. Archived from the original on 2007-03-14. Retrieved 2007-02-27.
- ↑ Discovery of the Elements: Third Edition (reprint). Kessinger Publishing.[permanent dead link]
- ↑ Dickin, Alan P (2005). "Neon". Radiogenic isotope geology. p. 303. ISBN 978-0-521-82316-6.[permanent dead link]
- ↑ Resources on Isotopes Periodic Table--Neon at the U.S. Geological Survey, by Eric Caldwell, posted January 2004, retrieved February 10, 2011
- ↑ Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. pp. 106–107. ISBN 978-0521823814.
- ↑ Ryan, Sean G. (2010). Stellar Evolution and Nucleosynthesis. Cambridge University Press. ISBN 978-0-521-13320-3.
- ↑ Asplund. "The Chemical Composition of the Sun".
- ↑ Gallagher, R.; Ingram, P. (2001-07-19). Chemistry for Higher Tier. University Press. p. 282. ISBN 978-0-19-914817-2.
- ↑ Morse, David (January 26, 1996). "Galileo Probe Science Result". Galileo Project. Archived from the original on February 24, 2007. Retrieved 2007-02-27.
- ↑ Steigerwald, William (17 August 2015). "NASA's LADEE Spacecraft Finds Neon in Lunar Atmosphere". NASA. Archived from the original on 19 August 2015. Retrieved 18 August 2015.
- ↑ Falenty, Andrzej; Hansen, Thomas C.; Kuhs, Werner F. (2014). "Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate". Nature. 516 (7530): 231–3. Bibcode:2014Natur.516..231F. doi:10.1038/nature14014. PMID 25503235. S2CID 4464711.
- ↑ Yu, X.. "Crystal structure and encapsulation dynamics of ice II-structured neon hydrate".
- ↑ Falenty, Andrzej; Hansen, Thomas C.; Kuhs, Werner F. (2014). "Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate". Nature. 516 (7530): 231–3. Bibcode:2014Natur.516..231F. doi:10.1038/nature14014. PMID 25503235. S2CID 4464711.
- ↑ R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries. ISBN 0-07-057145-7.
- ↑ "Explained: Why the Russia-Ukraine crisis may lead to a shortage in semiconductors". MSN (in Indian English). The Indian Express.
- ↑ Alper, Alexandra (2022-03-11). "Exclusive: Russia's attack on Ukraine halts half of world's neon output for chips". Reuters (in ఇంగ్లీష్). Retrieved 2022-03-16.
- ↑ "Rare Gasses Supplier Known for Innovation". The European Times. 2020.
- ↑ Ukraine war flashes neon warning lights for chips, Reuters, 2022-02-25

