Бутан (сполука)
| Бутан | |
|---|---|

| |

| |
| Інші назви | н-бутан |
| Ідентифікатори | |
| Номер CAS | 106-97-8 |
| PubChem | 7843 |
| Номер EINECS | 203-448-7 |
| KEGG | D03186 |
| ChEBI | 37808 |
| RTECS | EJ4200000 |
| SMILES | CCCC[1] |
| InChI | InChI=1S/C4H10/c1-3-4-2/h3-4H2,1-2H3 |
| Номер Бельштейна | 969129 |
| Номер Гмеліна | 1148 |
| Властивості | |
| Молекулярна формула | C4H10 |
| Молярна маса | 58,12 г/моль |
| Зовнішній вигляд | Безбарвний газ |
| Густина | 2,48 кг/м³ (при 15 °C) |
| Тпл | від −140 до −134 °C (від −220 до −209 °F; від 133 до 139 K) |
| Ткип | від −1 до 1 °C (від 30 до 34 °F; від 272 до 274 K) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Бута́н (англ. butane, нім. Butan) — органічна сполука, CH3CH2CH2CH3, газ без кольору й запаху.
Міститься в нафті та природних газах. Бутан, як правило, зустрічається тільки в газах пов'язаних з нафтовими покладами, що є ознакою, яка вказує на зв'язок газу з нафтою. Теплота згоряння бутану — від 112,3 до 121,4 МДж/м³.
Застосовують як паливо, а також для одержання бутадієну.
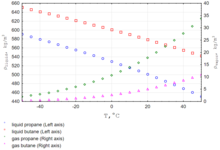
Маса 1 м³ бутану за нормальних умов дорівнює 2,48 кг. Густина бутану суттєво залежить від температури.[2]
Ізомери
Бутан має два ізомери: н-бутан та ізобутан.
Бутан нормальний, або н-бутан має у 2 рази більшу густину, ніж повітря. Маса 1 м³ бутану при 15 °С і нормальному тиску становить 2,454 кг. В чистому вигляді у газоподібному стані бутан може знаходитись при температурі вище +0,6 °С.
Ізобутан має той же хімічний склад, але відрізняється від нормального бутану внутрішньою будовою молекули. Його фізичні властивості дещо відрізняються від властивостей нормального бутану.
| Назва ізомера | Структурна формула |
|---|---|
| н-бутан | 
|
| ізобутан | 
|
Графічне зображення
H H H H
| | | |
H - C - C - C - C - H
| | | |
H H H H
Конформації

Найстабільнішою конформацією бутану є анти-конформація (остання на малюнку). При цьому кут між першим та останнім атомами вуглецю дорівнює 180° (якщо спостерігати по осі зв'язку С2-С3). Менш стабільною є конформація, при якій кут між цими атомами дорівнює 60° (друга на малюнку); на перехід з найстабільнішої конформації у цю витрачається 0,9 ккал/моль. Ще менш стабільною є конформація, при якій цей кут = 120° (третя на малюнку), оскільки атом вуглецю затуляє атом водню; для переходу в цю конформацію потрібно 3,6 ккал/моль. Найменш стабільною є конформація, при якій один атом вуглецю затуляє інший. Енергія, потрібна для переходу в цю конформацію становить 5,4 ккал/моль.
При 25°С 72 % молекул знаходяться в анти-конформації, а 28 % — у формі з кутом 60°.
Різновиди
Бутан товарний (англ. commercial butane; нім. warenbutan) — вуглеводнева рідина, що містить не менше 93 % бутанів або бутенів і має тиск насиченої пари не більше 0,5 МПа при 45 °C. При атмосферному тиску температура випаровування товарного бутану (об'ємна частка 95 %) не повинна перевищувати 1,2 °C. Вміст домішок пропан-пропілену обмежується 4 %. Рідкий залишок при 20 °C не повинен перевищувати 2 %, вміст сірководню — 50 мг/м³ газу, пентанів — до 35 %.
Біологічні ефекти
Вдихання бутану викликає асфіксію і серцеву аритмію. При попаданні на тіло зрідженого газу або струменя його випарів викликає охолодження ділянки до -20 °C, що вкрай небезпечно при інгаляціях.
Безпека
Легко спалахує. Межі вибуховості 1,9-8,4 % у повітрі за об'ємом. ГДК 300 мг/м³.
Примітки
- ↑ BUTANE
- ↑ а б Zivenko, Oleksiy (2019). LPG ACCOUNTING SPECIFICITY DURING ITS STORAGE AND TRANSPORTATION. Measuring Equipment and Metrology (англ.). Т. 80, № 3. с. 21—27. doi:10.23939/istcmtm2019.03.021. ISSN 0368-6418. Процитовано 18 листопада 2021.
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4
- О. А. Реутов, А. Л. Курц, К. П. Бутин. Органическая химия
| |||||