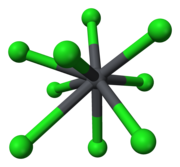
ஈயம்(II) குளோரைடு

| |
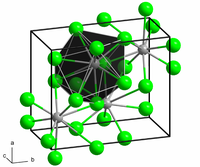 PbCl2 இன் படிக அமைப்பு.
| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
ஈயம்(II) குளோரைடு
ஈயம் டைகுளோரைடு | |
| வேறு பெயர்கள்
பிளம்பசு குளோரைடு
கோடண்ணைட்டு இருகுளோரோபிளம்பைலீன் | |
| இனங்காட்டிகள் | |
| 7758-95-4 | |
| ChEBI | CHEBI:88212 |
| ChemSpider | 22867 |
| EC number | 231-845-5 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 166945 |
| |
| UNII | 4IL61GN3YI |
| பண்புகள் | |
| PbCl2 | |
| வாய்ப்பாட்டு எடை | 278.10 g/mol |
| தோற்றம் | white odorless solid |
| அடர்த்தி | 5.85 g/cm3 |
| உருகுநிலை | 501 °C (934 °F; 774 K) |
| கொதிநிலை | 950 °C (1,740 °F; 1,220 K) |
| 0.99 g/100 mL (20 °C)[1] | |
கரைதிறன் பெருக்கம் (Ksp)
|
1.7×10−5 (20 °C) |
| கரைதிறன் | அமோனியா, HCl இல் சிறிதளவு கரையும், ஆல்ககாலில் கரையாது. சூடான நீரிலும் கார ஐதராக்சைடு முன்னிலையிலும் கரையும் அடர் ஐதரோகுளோரிக் காடியில் கரையும் (>6M) |
| −73.8·10−6 செ.மீ3/மோல் | |
| ஒளிவிலகல் சுட்டெண் (nD) | 2.199[2] |
| கட்டமைப்பு | |
| படிக அமைப்பு | செஞ்சாய்சதுரம், oP12 |
| புறவெளித் தொகுதி | Pnma (No. 62) |
| Lattice constant | a = 762.040 பைக்கோமீட்டர், b = 453.420 பைக்கோமீட்டர், c = 904.520 பைக்கோமீட்டர் |
| வெப்பவேதியியல் | |
| Std enthalpy offormation ΔfH |
-359.41 கிலோயூல்/மோல் |
| நியம மோலார் எந்திரோப்பி S |
135.98 யூல் K−1 மோல்−1 |
| தீங்குகள் | |
| GHS pictograms |   
|
| GHS signal word | அபாயம் |
| H302, H332, H351, H360, H372, H410 | |
| P201, P261, P273, P304+340, P308+313, P312, P391 | |
| Lethal dose or concentration (LD, LC): | |
LDLo (Lowest published)
|
140 மி.கி/கி.கி (கினியா பன்றி, வாய்வழி)[3] |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | ஈய(II) புளோரைடு ஈயம் இருபுரோமைடு ஈயம்(II) அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | ஈயம் டெட்ராகுளோரைடு வெள்ளீய(II) குளோரைடு செருமேனியம் இருகுளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
ஈயம்(II) குளோரைடு (Lead(II) chloride) என்பது PbCl2 என்ற மூலக்கூற்று வாய்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். சுற்றுச்சூழல் நிபந்தனைகளில் இது வெண்மை நிறத்தில் திண்மமாகக் காணப்படும். இது தண்ணீரில் குறைவாகக் கரையும். ஈயம்(II) குளோரைடு மிகவும் முக்கியமான ஈயம் சார்ந்த வினையாக்கிகளில் ஒன்றாகும். இயற்கையாக கோடண்ணைட்டு என்ற கனிம வடிவத்தில் தோன்றுகிறது.
கட்டமைப்பு
திண்மநிலை ஈயம்(II) குளோரைடின் கட்டமைப்பில் ஒவ்வோர் ஈயம் அயனியும் ஒரு மூவுச்சி முக்கோணப் பட்டகத்தின் உருவாக்கத்தில் ஒன்பது குளோரைடு அயனிகளால் ஒருங்கிணைக்கப்படுகின்றன. ஆறு ஈயம் அயனிகள் முக்கோண பட்டகத்தின் உச்சியில் உள்ளன. மூன்று அயனிகள் ஒவ்வொரு செவ்வகப் பட்டகத்தின் முகத்தின் மையங்களுக்கு அப்பால் உள்ளன. 9 குளோரைடு அயனிகள் மத்திய ஈய அணுவிலிருந்து சம தூரத்தில் இல்லை, 7 அயனிகள் 280-309 பைக்கோமீட்டர் தூரத்திலும் மற்றும் 2 அயனிகள் 370 பைக்கோமீட்டர் தூரத்திலும் இருக்கின்றன..[5] PbCl2 வெள்ளை நிறத்தில் செஞ்சாய்சதுர ஊசிகளாக உருவாகும்.
வாயு கட்டத்தில், PbCl2 மூலக்கூறுகள் Cl-Pb-Cl பிணைப்புக் கோணம் 98° ஆகவும், ஒவ்வொரு Pb--Cl பிணைப்பு தூரமும் 2.44 Å ஆகவும் வளைந்த கட்டமைப்பைக் கொண்டுள்ளன. இத்தகைய ஈயம்(II) குளோரைடு உள் எரிப்பு இயந்திரங்களில் இருந்து உமிழப்படுகிறது. எத்திலீன் குளோரைடு-டெட்ராஎத்தில் ஈயம் சேர்க்கைகளில் இடி எதிர்ப்புக்குப் இதைப் பயன்படுத்துகின்றன.[6]
PbCl2 தண்ணீரில் குறைவாக கரையும். 20 °செல்சியசு வெப்பநிலையில் கரைதிறன் பெருக்க மதிப்பு Ksp = 1.7×10−5 ஆகும். பொதுவாக நீரில் கரையாத 5 குளோரைடுகளில் இதுவும் ஒன்றாகும். தாலியம்(I) குளோரைடு, வெள்ளி குளோரைடு (AgCl) Ksp = 1.8×10−10, தாமிரம்(I) குளோரைடு (CuCl) Ksp = 1.72×10 Ksp = உடன் −7 மற்றும் பாதரசம்(I) குளோரைடு (Hg2Cl2). 1.3×10−18 என்பன மற்ற நான்கு குளோரைடுகளாகும்.[7][8]
தயாரிப்பு
காரீய(II) நைட்ரேட்டு மற்றும் காரீய(II) அசிட்டேட்டு போன்ற காரீய(II) சேர்மங்களின் நீரிய கரைசல்களுடன் நீரிய குளோரைடு மூலங்களை (HCl, NaCl, KCl) சேர்ப்பதன் மூலம் திண்ம ஈயம்(II) குளோரைடு வீழ்படிவாகக் கிடைக்கிறது.
- Pb(NO3)2 + 2 HCl → PbCl2(திண்மம்) + 2 HNO3
ஈயம்(II) ஆக்சைடு மற்றும் ஈயக் கார்பனேட்டு போன்ற கார ஈயம்(II) சேர்மங்களை சூடுபடுத்தினாலும் ஈயம்(II) குளோரைடு உருவாகிறது.
ஈயம்(IV) ஆக்சைடு குளோரைடு மூலம் பின்வருமாறு ஒடுக்கப்படுகிறது.
- PbO2 + 4 HCl → PbCl2(திண்மம்) + Cl2 + 2 H2O
தாமிரம்(II) குளோரைடு மூலம் காரீயம் உலோகத்தை ஆக்சிசனேற்றம் செய்வதன் மூலமும் உருவாக்கலாம்.
- Pb + CuCl2 → PbCl2 + Cu
அல்லது ஈயம் உலோகத்தின் மீது நேரடியாகக் குளோரின் வாயுவைச் செலுத்தி வினைபுரியச் செய்வதன் மூலம் தயாரிக்கலாம்.
- Pb + Cl2 → PbCl2
வினைகள்
PbCl2 இன் தொங்கல் கரைசலுடன் குளோரைடு அயனிகளைச் சேர்ப்பது கரையக்கூடிய அணைவு அயனிகளை உருவாக்குகிறது. இந்த எதிர்விளைவுகளில் கூடுதல் குளோரைடு (அல்லது மற்ற ஈந்தணைவிகள்) திண்ம PbCl2(திண்மம்) பல்லுருவக் கட்டமைப்பை உள்ளடக்கிய குளோரைடு பாலங்களை உடைக்கிறது.
- PbCl2(திண்மம்) + Cl− → [PbCl3]−(நீரிய)
- PbCl2(திண்மம்) + 2 Cl− → [PbCl4]2−(நீரிய)
PbCl2 உருகிய சோடியம் நைட்ரைட்டுடன் NaNO2 வினைபுரிந்து PbO சேர்மத்தைக் கொடுக்கிறது:
- PbCl2(l) + 3 NaNO2 → PbO + NaNO3 + 2 NO + 2 NaCl
ஈயம்(IV) குளோரைடு (PbCl4) தயாரிப்பில் PbCl2 பயன்படுத்தப்படுகிறது. Cl2 ஆனது அமோனியாவில் கரைந்த PbCl2 இன் நிறைவுற்ற கரைசல் மூலம் செலுத்தும்போது [NH4]2[PbCl6] உருவாகிறது. . பிந்தையது செறிவூட்டப்பட்ட குளிர்ந்த கந்தக அமிலத்துடன் (H2SO4) வினைபுரிந்து PbCl4 எண்ணெயை உருவாக்குகிறது.
ஈயம்(II) குளோரைடு என்பது ஈயத்தின் பிளம்போசீன்கள் போன்ற கரிம உலோக வழிப்பெறுதிகள் தயாரிக்கப் பயன்படும் ஒரு முதன்மையான முன்னோடிச் சேர்மமாகும்.[9] வழக்கமான ஆல்கைலேற்றும் முகவர்கள் இதற்காகப் பயன்படுத்தப்படுகின்றன. கிரிக்னார்டு வினையாக்கி மற்றும் கரிமலித்தியம் சேர்மங்களும் அடங்கும்:
- 2 PbCl2 + 4 RLi → R4Pb + 4 LiCl + Pb
- 2 PbCl2 + 4 RMgBr → R4Pb + Pb + 4 MgBrCl
- 3 PbCl2 + 6 RMgBr → R3Pb-PbR3 + Pb + 6 MgBrCl
இந்த எதிர்விளைவுகள் கரிமசிலிக்கன் சேர்மங்களுக்கு மிகவும் ஒத்த வழித்தோன்றல்களை உருவாக்குகின்றன, அதாவது Pb(II) ஆல்கைலேற்றத்தில் விகிதாசாரமாக மாறுகிறது.
சோடியம் ஐப்போகுளோரைட்டு (NaClO) ஈயம்(II) குளோரைடு சேர்த்து சூடுபடுத்துவதன் மூலம் PbO2 சேர்மத்தை உற்பத்தி செய்ய முடியும் இது PbO2 இன் செம்-பழுப்பு நிற படிகங்களை உருவாக்குகிறது.
பயன்கள்
ஈய தைட்டனேட்டு, பேரியம் ஈயதைட்டனேட்டு பீங்கானை நேர்மின் அயனி மாற்று வினையால் தயாரிக்க உருகிய ஈயம்(II) குளோரைடு பயன்படுத்தப்படுகிறது: [10]
- x PbCl2(l) + BaTiO3(s) → Ba1−xPbxTiO3 + x BaCl2
PbCl2 அகச்சிவப்பு கடத்தும் கண்ணாடி[11] மற்றும் ஆரேன் கண்ணாடி எனப்படும் அலங்கார கண்ணாடி உற்பத்தியில் பயன்படுத்தப்படுகிறது. ஆரேன் கண்ணாடியானது PbCl2 தெளிப்பதன் மூலமும் கட்டுப்படுத்தப்பட்ட நிலைமைகளின் கீழும் மீண்டும் சூடாக்குவதன் மூலமும் உருவான ஒரு மாறுபட்ட மேற்பரப்பைக் கொண்டுள்ளது. சிடானசு குளோரைடு (SnCl2) அதே நோக்கத்திற்காக பயன்படுத்தப்படுகிறது.[12]
PbCl2 சேர்மமானது HCl இல் சிறிது கரையக்கூடியதாக இருந்தாலும் HCl சேவையில் Pb பயன்படுத்தப்படுகிறது. 6-25% ஆண்டிமனியைச் (Sb) சேர்ப்பது அரிப்பு எதிர்ப்பை அதிகரிக்கிறது.[13]
ஈயத்தின் காரக்குளோரைடு, PbCl2·Pb(OH)2, பாட்டின்சன் வெள்ளை ஈயம் என்று அறியப்படுகிறது. மேலும் இது வெள்ளை வண்ணப்பூச்சில் நிறமியாகப் பயன்படுத்தப்படுகிறது.[14] 1921 ஆம் ஆண்டின் வெள்ளை ஈயம் (வண்ணம் தீட்டல்) உடன்படிக்கையால் பல நாடுகளில் ஈய வண்ணம் தீட்டல் இப்போது ஓர் உடல்நலக் கேடு என்று தடைசெய்யப்பட்டுள்ளது.
PbCl2 என்பது பிசுமத் (Bi) தாதுவை சுத்திகரிப்பதில் ஓர் இடைநிலை ஆகும். Bi, Pb மற்றும் Zn கொண்ட தாது முதலில் ஆர்சனிக்கு மற்றும் தெலூரியத்தின் தடயங்களை அகற்ற உருகிய எரி சோடாவுடன் சேர்த்து சூடுபடுத்தப்படுகிறது. இதைத் தொடர்ந்து, வெள்ளி மற்றும் தங்கத்தை அகற்ற பார்க்சு செயல்முறை மேற்கொள்ளப்படுகிறது. தாதுவில் இப்போது Bi, Pb மற்றும் Zn உள்ளன. 500 °செல்சியசு வெப்பநிலையில் இது Cl2 வாயுவிலிருந்து சூடுபடுத்தப்படுகிறது. முதலில், ZnCl2 உருவாகிறது மற்றும் வெளியேற்றப்படுகிறது. PbCl2 படிவங்களுக்குப் பிறகு தூய்மையான Bi பின்தங்கி நீக்கப்படும். கடைசியாக, BiCl3 உருவாகும்.[15]
நச்சுத்தன்மை
மற்ற கரையக்கூடிய ஈய சேர்மங்களைப் போலவே, PbCl2 சேர்மமும் வெளிப்பாட்டுகு உட்பட்டால் ஈய நச்சுத்தன்மையை ஏற்படுத்தும்.
மேற்கோள்கள்
- ↑ NIST-data review 1980 பரணிடப்பட்டது 2014-02-11 at the வந்தவழி இயந்திரம்
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, பன்னாட்டுத் தரப்புத்தக எண் 0-07-049439-8
- ↑ "Lead compounds (as Pb)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Classifications - CL Inventory". echa.europa.eu.
- ↑ Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications பன்னாட்டுத் தரப்புத்தக எண் 0-19-855370-6
- ↑ Hargittai, I; Tremmel, J; Vajda, E; Ishchenko, A; Ivanov, A; Ivashkevich, L; Spiridonov, V (1977). "Two independent gas electron diffraction investigations of the structure of plumbous chloride". Journal of Molecular Structure 42: 147–151. doi:10.1016/0022-2860(77)87038-5. Bibcode: 1977JMoSt..42..147H.
- ↑ CRC Handbook of Chemistry and Physics, 79th Edition, David R. Lide (Ed), p. 8-108
- ↑ Brown, Lemay, Burnsten. Chemistry The Central Science. "Solubility-Product Constants for Compounds at 25 °C". (ed 6, 1994). p. 1017
- ↑ Lowack, R (1994). "Decasubstituted decaphenylmetallocenes". J. Organomet. Chem. 476: 25–32. doi:10.1016/0022-328X(94)84136-5. https://zenodo.org/record/1253944.
- ↑ Aboujalil, Almaz; Deloume, Jean-Pierre; Chassagneux, Fernand; Scharff, Jean-Pierre; Durand, Bernard (1998). "Molten salt synthesis of the lead titanate PbTiO3, investigation of the reactivity of various titanium and lead salts with molten alkali-metal nitrites". Journal of Materials Chemistry 8 (7): 1601. doi:10.1039/a800003d.
- ↑ Dictionary of Inorganic and Organometallic Compounds. Lead(II) Chloride.[1]
- ↑ Kirk-Othmer. Encyclopedia of Chemical Technology. (ed 4). p 913
- ↑ Kirk-Othmer. Encyclopedia of Chemical Technology. (ed 4). p 913
- ↑ Perry & Phillips. Handbook of Inorganic Compounds. (1995). p 213
- ↑ Kirk-Othmer. Encyclopedia of Chemical Technology. (ed 4). p. 241