Vety
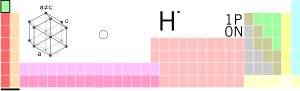
| |||||
| Almoliih ääših | |||||
| Nommâ | Vety | ||||
| Tubdâldâh | H | ||||
| Oornigloho | 1 | ||||
| Luokka | epimeetaal | ||||
| Laigos | s | ||||
| Juávkku | 1 (alkaalmeetaal) | ||||
| Ráiđu | 1 | ||||
| Saahâdvuotâ | 0,0000899 · 103 kg/m3 | ||||
| Ivne | ivnettem | ||||
| Kavnâmihe, kävnee | 1766, Henry Cavendish | ||||
| Aatoomjiešvuođah | |||||
| Aatoommassa (Ar) | 1,00794 | ||||
| Aatoomsuonjâr, mittedum (rekinistum) | 25 (53) pm | ||||
| Kovalentsuonjâr | 37 pm | ||||
| Van der Waals suonjâr | 120 pm | ||||
| Orbitaalrááhtus | 1s1 | ||||
| Elektroneh elektronkoorâin | 1 | ||||
| Hapittemlovoh | +I, -I | ||||
| Kristalrááhtus | kuuđâčievâg | ||||
| Fysikaallâš jiešvuođah | |||||
| Orroomhäämi | kaasu | ||||
| Suddâmčuogâstâh | 14,01 K (-259,14 °C) | ||||
| Tuoldimčuogâstâh | 20,28 K (-252,87 °C) | ||||
| Kuulmâsčuogâstâh | 13,8033 K já 7,04 kPa | ||||
| Kriittisâš čuogâstâh | 33,20 K já 1 300 kPa | ||||
| Moolisaijaavuotâ | 11,42 · 10−3 m3/mol | ||||
| Suddâmliegâsvuotâ | 0,117 kJ/mol | ||||
| Lievlâlumliegâsvuotâ | 0,904 kJ/mol | ||||
| Lievlâteedâ | 209 Pa 23 K:st | ||||
| Jienâ liähtu | 1 310 m/s 300 K:st | ||||
| Eres jiešvuođah | |||||
| Elektronegatiivlâšvuotâ | 2,1 (Pauling ciäkkádâh) | ||||
| Jiešvuođâlâš liegâsvuotâkapasiteet | (H2) 14,304 kJ/kg·K | ||||
| Liegâsvuođâsirdem | 0,1805 W/(m·K) | ||||
| CAS-nummeer | 1333-74-0 | ||||
| Tiäđuh normaalliegâsvuođâst já -teddust | |||||
Vety lii algâaamnâs, mon kemiallâš merkkâ lii H (hydrogenium), oornigloho 1 já aatoomtiäddu 1,00794 u. Vety lii epimeetaal, mut tot lii kuittâg-uv siämmáá juávhust alkaalmetallijgijn, ko tast lii alkaalmetallij náál ohtâ olgoelektron. Vety lii visteliegâsvuođâst ivnettes, hajâttem já mávuttem kaasu, mii lii keppisub ko áimu. Vety oro táválávt vetymolekyylin (H2). Ton suddâmčuogâstâh lii -259 °C já tuoldimčuogâstâh -253 °C.
Vety tobdosumos ovtâstâh lii čääci (H2O). Čääci lii haapi lasseen tergâdumos aamnâs Eennâmpáálust tiettum elimân. Stuárráámus uási eennâmpáálu vetyst lii čääccin. Vety lii mottoom verd meid eennâmkoorâst (0,14 %) já áimukeerdist (0,00005 %). Vety lii maailmubâlâšvuođâ almosumos algâaamnâs, já tot tuáimá taasnij fuusioreaktioi puáldimamnâsin.
Jiešvuođah
Isotoopeh
Vetyst láá kyehti stäđis isotoop, main táválumos lii 1H ađai protium. Protiumist lii tuše ohtâ prootoon ige ohtâgin neutron. Maailmubâlâšvuođâ puoh vetyst protium lii 99,98 %. Vety eres stäđis isotoopeh láá 2H ađai deuterium. Deuteriumist láá ohtâ prootoon já ohtâ neutron. 0,015 % puoh vetyst lii deuterium. Čääci, mast lii táválii vety saajeest deuterium, kočoduvvoo lusis čääccin. Lusis čääci lii kevttum aatoomvyeimilágádâsâi reaktorij čuáskudeijen.
Vety merhâšitteemus radioisotoop lii 3H ađai tritium, mast láá kyehti neutron. Tritium pelilumäigi lii 12,32 ihheed, já tot lii tuše 0,0001 % puoh vetyst. Tritium lii kevttum merkkâamnâsin isotoopgeokemiast sehe talhâsamnâsij metaboliatutkâmušâin. Vety eres radioisotoopeh láá 4H, 5H, 6H já 7H, mut toh láá uáli epistáđáseh, iäge toh tiettuu luándust.
Spin-isomeria
Vetymolekyylist láá kyehti spin-isomeer ađai häämi, mast molekyyl atomij protonij spineh láá ereslágáneh. Ortovetyst spineh láá siämmáásundásiih já paravetyst eressundásiih. Orto- já paravetyst láá ereslágáneh jiešvuođah: Ovdâmerkkân ortovety lievlâlumliegâsvuotâ lii 0,24 °C aaleeb ko paravetyst. Visteliegâsvuođâst 75 % vetyst lii ortovety, mut kolgos häämist sehe alda absoluutlâš nolláčuogâstâh masa puoh vety lii paravetyn.
Vety algâamnâsij ráiđulâš vuáháduvvâst
Táválávt vety lii sajettum algâamnâsij ráiđulâš vuáháduvvâst vuosmuu sárgáttâhân ađai siämmáá sajan ko alkaalmetalleh. Vety lii kuittâg-uv viehâ ereslágán ko alkaalmetalleh: Vety ij reagist čassijn nuuvt ko ovdâmerkkân litium, natrium teikkâ kalium. Tot lii meid táválávt luokattâllum epimetallin. Ton lasseen vety ionistemenergia já elektronegatiivlâšvuotâ láá ennuv stuárráábeh ko alkaalmetallij västideijeeh. Vety ionistemenergia (1310 kJ/mol) västid eenâb halogeenij ionistemenergiaid. Vety sulâstit halogeenijd meid tondiet ko ton elektronráhtusist šadda stääđis, jis tot finnee oovtâ elektron.
Vety kuittâg-uv sulâstit alkaalmetallijd maaŋgâ ääšist: Sehe alkaalmetalleh já vety láá s-laigosist, ađai toi olgolumos aatoomorbitaal lii s-orbitaal, ko halogeenijn olgolumos lii p-orbitaal. Ton lasseen vety elektronaffiniteetárvu lii 73 kJ/mol, ko alkaalmetallij áárvuh láá suulân 50 kJ/mol já halogeenij -300 kJ/mol. Vety epičielgâs sajattuv tááhust kemia sánáduvvâst västideijee IUPAC lii avžuuttâm, ete vety ferttiiččij leđe vuosmuu rááiđust kaskoo ráiđulii vuáháduv, kuás tot ij liččii alkaalmetallij ijge halogeenij juávhust.
Suuvrah já alkaaleh
Suvrâ já alkaal láá Brønsted–Lowry-teoria mield miäruštâllum tienuuvt, ete suvrâ lii aamnâs, mii luovât vetyioni ađai prootoon (H+). Alkaal lii vuod aamnâs, mii vuástáváldá vetyioni. Suuvres čäcilaggâ šadda, ko čääci vuástáváldá vetyioni já tast šadda oksoniumioni (H3O+). Alkaallâš čäcilaggâ šadda, ko čääci luovât vetyioni já tast šadda hydroksidioni (OH-). Laagâ suvroduv teikkâ alkaallâšvuođâ vieksâvuotâ sorjo oksonium- teikkâ hydroksidionij meereest.
Vety ovtâstuvah
Vetyovtâstuvâid puáhtá jyehiđ čonnâsijdis vuáđuld kovalentsâš, ioničoonâslâš já meetaallâš ovtâstuvváid. Kovalentsâš ovtâstuvah láá vety já eres epimeetaal ovtâstuvah, nuuvtko čääci, ammoniak já vetyhalogenideh. Taah ovtâstuvah láá visteliegâsvuođâst táválávt kaasun. Ioničoonâslâš ovtâstuvah láá elektropositiivlâš alkaal- teikkâ eennâmalkaalmeetaalioni já elektronegatiivlâš hydridioni (H-) ovtâstuvah. Taah hydrideh reagisteh vuáimálávt čassijn, mast šaddeh vetykaasu já meetaalhydroksid.
Sirdâšemmetallijguin, lantanoidijguin já aktinoidijguin vety ráhtá meetaallâš ovtâstuvâid.
Historjá
Putes vety valmâštij vuossâmužžân eŋlandlâš kemist-fysikkár Henry Cavendish ive 1766, ko sun laggij ryevdi riššâsuuvrân já tast šoodâi tubdâmettum kaasu. Cavendish meid merkkui, ete vety já ááimu siävus pävkittij já tast šoodâi kolgos. Ive 1781 Cavendish kavnâttij, ete kolgos lâi čääci. Siämmást sun komettij Aristoteles já Kreika eres luándufilosofij jurduu tast, ete čääci lii algâaamnâs. Cavendish ij tiättám, ete sun lâi kavnâm uđđâ algâamnâs, pic juurdij, ete kaasu lâi flogiston. Ovdil Cavendish, meid alkemist Paracelcus já eŋlandlâš Robert Boyle valmâštáin vety, mut suoi iävá tutkâm ton jiešvuođâid teikkâ ubâ tiättámgin, mii tot lâi.
Ranskalâš kemist Antoine Lavoisier adelij vetyn noomâ hydrogène, mii puátá kreikkâkielâ saanijn ὕδωρ (hydor, čääci) já γίγνομαι (gignomai, rähtiđ, šoddâdiđ). Noomâ suijân lii vety já haapi koskâsâš reaktio, mast šadda čääci.
Kiävttu
Onnáá peeivi vety lii kevttum ammoniak valmâštâsâst. Ammoniak valmâštuvvoo Haber-Bosch-vuovvijn vetyst já tyypist. Vety lii kevttum meid oljojáálludmist, mast vetyin puáhtá lasettiđ čiđđâvetyi vety-čiđđâ-koskâvuođâ já návt pyerediđ toi pyellim. Vetyin puáhtá meid meddâlistiđ oksidijd maalmâin já riišâ oljoost sehe valmâštiđ metanol čiđđâmonoksidijn.
Kolgosvety lii kuáddurakettij pyeremus puáldimaamnâs. Hapitteijen lii táválávt kolgoshappi. Vâi happi já vety pisoh kolgosin, ferttee liegâsvuotâ leđe vuálá -183 °C. Tondiet rakettij puáldimamnâs siäiluttem kuhháá lii väädis.